
下列说法中,正确的是
A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性
B.足量的铜跟一定量的浓硝酸反应只产生一种气体
C.氮的固定只有在高温、高压、催化剂的条件下才能实现
D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列各组离子,在碱性条件下能大量共存,在强酸性条件下发生氧化还原反应的是
A.Mg2+、Na+、SO42-、HCO3— B.Na+、K+、NO3—、SO32—
C.K+、Na+、SiO32—、ClO— D.NH4+、Na+、SO42—、NO3—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:

(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是
A.甲烷和氯气的反应与乙酸乙酯水解的反应属于同一类型的反应
B.蛋白质和油脂虽然都属于高分子化合物,但水解生成的产物不同
C.石油化工得到的产品均为液体,煤化工得到的产品有液体,也有固体
D.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量多于乙烯的
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 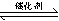 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的最佳途径是使用高效催化剂
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的常用方法是升高温度
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g) 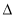 H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.050 | 0.025 | 0.025 |
30 | 0.050 | 0.025 | 0.025 |
40 | 0.036 | 0.032 | 0.010 |
50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
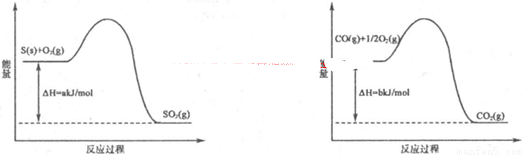
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
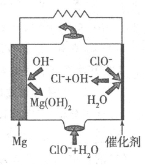
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
已知有机物A分子由C、H、O三种元素组成,其蒸汽密度是相同条件下氢气密度的60倍,0.1molA在足量的氧气中充分燃烧后生成0.8molCO和7.2gH2O,A可以发生银镜反应,其苯环上的一氯代物有3种。
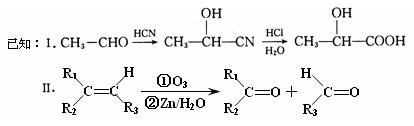
现有如下转化关系: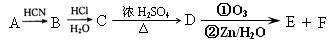 其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
(1)A中含氧官能团的名称是 ,A的结构简式为 。
(2)C可能具有的化学性质有 (填序号)。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3) 2OH溶液发生银镜反应
⑤能与NaOH溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3) ① 写出C→D的化学反应方程式_______ ;反应类型为_____________________。
② 催化剂条件下,D生成高聚物的化学方程式 ;
③ G与足量NaHCO3溶液反应的化学方程式 。
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物 ②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀 ④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式 。
(5)聚乳酸(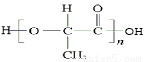 )可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
)可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
合成路线示例: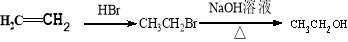
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.阿司匹林是解热镇痛药,长期大量食用会有水杨酸反应,应停药并静脉注射NaHCO3溶液
B.食用一定量的油脂能促进人体对某些维生素的吸收
C.正常情况下,人体血液的pH总保持弱酸性范围,人体具有自动缓冲系统,能使血液的pH达到生理平衡
D.雾霾会引起呼吸道疾病
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
实验:①0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
A.滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+ 2OH-(aq)
Mg2+(aq)+ 2OH-(aq)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com