

分析 (1)合成氨反应方程式为3H2(g)+N2(g)?2NH3(g)、2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)、CO(g)+$\frac{1}{2}$O2(g)?CO2(g),将这三个方程式相加得3H2(g)+N2(g)+CO(g)+$\frac{1}{2}$O2(g)?CO(NH2)2(s)+H2O,据此判断H2、CO的合适体积比;
(2)该反应的平衡常数表达式为K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
(3)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
(4)增大压强平衡向气体体积减小的方向移动;
由于该反应中,气体每减小2mol,生成1molCO(NH2)2是固体,气体质量减小60g,即减少的混合气体的平均相对分子质量为30,当起始混合气体的相对分子质量为30时,平衡正向移动,但混合气体的平均相对分子质量始终为30,所以加压时混合气体的平均相对分子质量不变;
(5)HCl和氨气生成氯化铵,平衡逆向移动;混合气体的相对分子质量增大.
解答 解:(1)合成氨反应方程式为3H2(g)+N2(g)?2NH3(g)、2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)、CO(g)+$\frac{1}{2}$O2(g)?CO2(g),将这三个方程式相加得3H2(g)+N2(g)+CO(g)+$\frac{1}{2}$O2(g)?CO(NH2)2(s)+H2O,根据方程式知H2、CO的合适体积比为3:1,
故答案为:3:1;
(2)该反应的平衡常数表达式为K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$,故答案为:$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
(3)A.无论反应是否达到平衡状态都存在消耗NH3的物质的量的生成H2O的物质的量之比为2:1,不能据此判断平衡状态,故错误;
B.当c(NH3):c(CO2):c(H2O)=2:1:1时该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;
C.反应前后气体质量改变、容器体积不变,所以气体密度改变,当气体密度不再变化时正逆反应反应速率相等,该反应达到平衡状态,故正确;
D.该反应前后气体计量数之和不等,当气体压强不再变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选CD;
(4)该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡向气体体积减小的方向移动,所以向正反应方向移动;
由于该反应中,气体每减小2mol,生成1molCO(NH2)2是固体,气体质量减小60g,即减少的混合气体的平均相对分子质量为30,当起始混合气体的相对分子质量为30时,平衡正向移动,但混合气体的平均相对分子质量始终为30,设NH3与CO2的物质的量分别是x、y,其平均摩尔质量=$\frac{17x+44y}{x+y}g/mol=30g/mol$,x:y=14:13,
故答案为:正反应;14:13;
(5)HCl和氨气生成氯化铵,平衡逆向移动;二氧化碳相对分子质量大于水蒸气,所以混合气体的相对分子质量增大,故答案为:逆反应;增大.
点评 本题考查化学平衡计算、化学平衡状态判断、化学平衡影响因素等知识点,较综合,难点是(4)题计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
| B | SiO2导电能力强 | 可用于制造通讯光缆 |
| C | Al有还原性,在某些反应中热效应大 | 利用铝热反应冶炼金属Mn |
| D | 常温下铁与浓硫酸、浓硝酸均不反应 | 可用铁槽车密封运送浓硫酸、浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2SO4 | C. | CuSO4 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
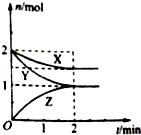 在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用于食品、羽毛和织物等的漂白 | |
| B. | 含盐腌制品不宜直接存放在铝制容器中 | |
| C. | 燃放烟花是利用了某些金属元素的焰色反应 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗前不用检查活塞处是否漏水 | |
| B. | 放气时,直接打开上口玻璃塞 | |
| C. | 分液操作时,下层液体从下端放出,上层液体从上口倒出 | |
| D. | 应选用球形分液漏斗进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com