
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.Y极反应式为V2+-e-=V3+
D.每转移1 mol,电子理论上有2 mol H+由交换膜右侧向左侧迁移
【答案】C
【解析】
电池是高考常考题型之一,主要涉及电极判断、电极反应式的书写、离子移动、PH变化、计算。
A. 观察装置,由物质转化可以确定右边发生氧化反应,Y极为负极,左边发生还原反应,X为正极。电子只能在导线上迁移,即电子由Y极经导线流向X极,故A错误。
B. 放电过程中,电池反应式为V2++VO2++2H+=V3++VO2++H2O,消耗H+,pH升高,故B错误。
C. Y极为负极,发生氧化反应,由离子转化关系知反应式为V2+-e-=V3+,故C正确。
D. X极反应式为VO2++2H++e-=VO2++H2O,得失电子数决定氢离子迁移数目。转移1mol电子,只有1molH+迁移,故D错误。
故答案选C。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】2018年北京市公交行业迈入氢能源时代。“制氢”“储氢”“用氢”等一直都是能源研究的热点。工业上制取H2有多种方法.如:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________________ .
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的_______倍(计算结果保留两位有效数字)。
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是 _____(填字母代号)。

a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6![]() LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾醉驾危害社会安全,早期测定是否饮酒的方法是重铬酸钾法:溶液由橙红色变为绿色(Cr3+)则表明已经饮酒。写出重铬酸钾法检验饮酒的离子方程式:___________________________。
(2)用铬铁矿(FeOCr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺:
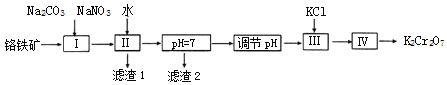
已知:i. 2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O;
Cr2O72﹣+H2O;
ii.常温,Ksp[Al(OH)3]=1.3×10﹣33;
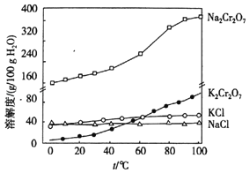
iii.有关物质的溶解度曲线如图:
①上述工艺流程图中的操作I的主要反应为:2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
②滤渣2的成分是_____(写化学式),常温,滤液中,c(Al3+)=_____molL﹣1
③工艺流程图中,操作“调节pH”的作用是_________________________________。
④操作Ⅲ,加入KCl的目的是________________________________________;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率___(填“增大”“减小”或“不变”)。
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,反应前15min用SO3表示的平均反应速率为___。
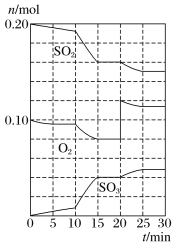
(3)已知0-15min反应放出的总热量为QkJ,写出该反应的热化学方程式____。
(4)根据如图判断,10min时改变的反应条件可能是___(填编号,下同);20min时改变的反应条件可能是____。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
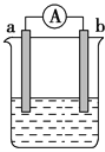
(1)若电极a为Zn,电极b为石墨,当电解质溶液为稀硫酸时,该电池的负极的电极反应式为:___;当反应中收集到标准状况下672 mL气体时,电池中所转移的电子数目为____。
(2)现设计一燃料电池,以电极a为正极,电极b为负极,甲醇(CH4O)为燃料,采用氢氧化钠溶液为电解质溶液,则氧气应通入____极(填“a”或“b”),另一电极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以利用镁粉在加热条件下与氮气反应制备氮化镁。用一瓶氮气样品(含少量CO2、CO、O2)制备氮化镁。已知:连苯三酚碱性溶液定量吸收O2;CuCl的盐酸溶液能定量吸收CO且易被O2氧化。
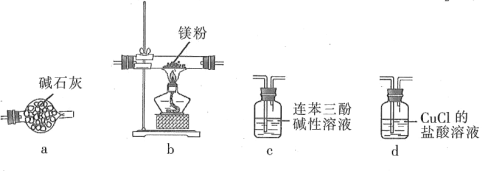
下列说法正确的是
A.装置连接顺序:氮气样品→d→c→a→b
B.装置a可以用盛装浓硫酸的洗气瓶替代
C.若先点燃酒精灯后通气体,产品纯度降低
D.d装置中的CuCl在除杂中表现还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料可以合成有关产品,其流程如图:
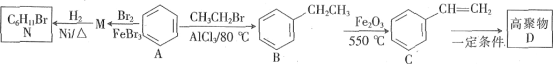
回答下列问题:
(1)B的名称是____。
(2)1个C分子最多有___个原子共平面。
(3)A→M的反应类型是___;C中官能团名称是___。
(4)写出M→N的化学方程式:____。
(5)N的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、A1O2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol L-1的盐酸,发生的现象是开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435 g。
下列说法中正确的是
A.该溶液中一定不含有Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液中是否含有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com