
��������ҽҩ��ʯ����ҵ���й㷺��;����ͼ��ģ�ҵ�Ʊ��������Ʒ�����Ƶ����̣�
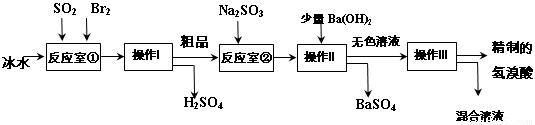
��֪��Br2���ӷ��������ɫ��Һ�壻���������ӷ�����ɫҺ�塣
�����������̻ش��������⣺
��1����Ӧ�Ң��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�Ң�ʹ�ñ�ˮ��Ŀ�� ��
��3������I������ ���������õ��IJ��������� ��
��4����Ӧ�Ң��м���Na2SO3��Ŀ���� ��
��5����ҵ�������Ƶõ���������е����Ļ�ɫ�����Ǽ�����ͬѧ�����ʵ�����̽����
�ټ�ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ��Fe3����������֤���ü������õ��Լ�Ϊ ������������ɹ۲쵽������Ϊ ��
����ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ ��������֤���ü�������ķ���Ϊ ��
��1��SO2+Br2+2H2O=H2SO4+2HBr ��2����ֹBr2��HBr�ӷ�
��3������©�������������ձ��� ��4����ԭ��Ʒ�е�Br2
��5����KSCN��Һ����������KSCN��Һ���ɫ�����������к���Br2���ò�����պȡ�Ƶõ������ᣬ����ʪ�����KI��ֽ�ϱ��������ý�ͷ�ι�ȡ�Ƶõ����������Թ��У��μ�CCl4������ֹ���²�ʳȺ�ɫ����֤����Br2���Ի�ɫ��
��������
�����������1����Ӧ�Ң���SO2��Br2�ڱ�ˮ�з�����Ӧ�Ļ�ѧ����ʽΪSO2+Br2+2H2O=H2SO4+2HBr����2����Ӧ�Ң�ʹ�ñ�ˮ��Ŀ����Ϊ�˷�ֹBr2��HBr�ӷ�����Ⱦ������Ӱ���������3������I�Ƿ��뻥�ܵķе㲻ͬ��Һ�����ʵIJ��������������������õ��IJ���������©�������������ձ�����4����Ӧ�Ң��м���Na2SO3��Ŀ����Ϊ������Ϊ��Ӧ��Br2��������ʵĴ��ȡ���5����ҵ�������Ƶõ���������е����Ļ�ɫ���ټ�ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ��Fe3��������ķ�����ȡ��������Һ�������еμӼ���KSCN��Һ������ҵ��������KSCN��Һ���ɫ����֤������Fe3��������Ͱɺ���Fe3��������ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ����Br2������ķ�����������ǿ�����ԡ��ò�����պȡ�Ƶõ������ᣬ����ʪ�����KI��ֽ�ϱ�����Ҳ�������������л��ܼ��е��ܽ�ȴ�����ʡ��ý�ͷ�ι�ȡ�Ƶõ����������Թ��У��μ�CCl4������ֹ���²�ʳȺ�ɫ����֤����Br2���Ի�ɫ��
���㣺����SO2��Br2�����ʡ������ķ��뷽����������Fe3����Br2�ļ��鷽����֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��ׯ�и�����ѧ�ڵڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����( )
A��Na2S2O3��Һ�м���ϡ���2S2O32����2H��=SO42����3S����H2O
B����������������ϡ���3Fe3O4��28H����NO3�� 9Fe3����NO����14H2O
9Fe3����NO����14H2O
C��100ml0.1mol/L FeI2��Һ������0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D����������Һ�еμ�Ba(OH)2��Һ��ǡ��ʹSO42-������ȫ��2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3��+3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���������У����4���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳ������������ȼ�ϵ�أ�RFC����RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ�ŵ�ء���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ���ǣ��� ��
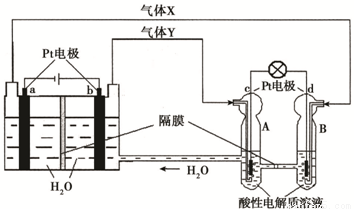
A������0.1 mol����ת��ʱ��a��������״����1.12 L H2
B�����װ���л�ѧ��ת��Ϊ���ܣ��Ҷ�װ���е���ת��Ϊ��ѧ��
C��c���Ϸ����ĵ缫��Ӧ�ǣ�O2 + 2H2O + 4e- �� 4OH��
D��d���Ͻ��л�ԭ��Ӧ���Ҷ�װ��B�е�H+����ͨ����Ĥ����A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱����ͨ���������꼶ģ�⿼�ԣ�һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
�����ڼ���ȼ�ű��ڻ����������SO2�������ߣ���ɴ�����Ⱦ��ijʵ��С��ͬѧ��̽��SO2�����ʣ����ⶨ������SO2�ĺ�����
��1�������������ʵ��װ�ã��������̽�������ش����⣺
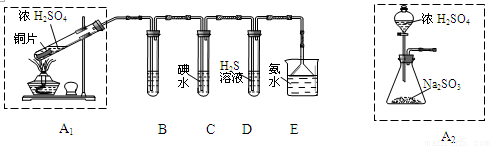
��װ��A1�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��װ��B���ڼ���SO2��Ư���ԣ�������ʢ�Լ�Ϊ ��װ��D���ڼ���SO2�� ���ʣ�
��װ��C�з�Ӧ�����ӷ���ʽΪ ��
��Ϊ��ʵ����ɫ������Ŀ�꣬��ͬѧ����װ��A2����װ��A1������Ϊװ��A2���ŵ��ǣ�д���㣩 �� ��
��2�������������·����ⶨ������SO2�����������������������ԭ�����壩��

������Ϊ�ĸ�װ�ÿ��У�����ţ� ��ʹ������ѡ�õ�װ�òⶨSO2����ʱ������Ҫ�ⶨ���������� ��
������Ϊ�ĸ�װ�ò����У�����ţ� ��˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱����ͨ���������꼶ģ�⿼�ԣ�һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ᴿ����������ѡ�Լ�����Ӧ���뷽�������е���
| �� �� | �� �� | �� ѡ �� �� | �� �� |
A | ���� | ��ϩ | ����KMnO4��Һ | ϴ�� |
B | �屽 | �� | H2O | ��ȡ |
C | ���� | ���� | NaOH��Һ | ���� |
D | �������� | ���� | ����Na2CO3��Һ | ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱���з�ɽ������һģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ˮ�е�NH4����һ�������¿���O2�������·�Ӧ��
�� NH4��(aq) + 3/2O2(g) = NO2��(aq) + 2H��(aq) + H2O(l) ��H = -273kL/mol
�� NO2��(aq) + 1/2O2(g) = NO3��(aq) ��H = -73kL/mol
������������ȷ����
A�������¶ȣ���ʹ�٢ڷ�Ӧ���ʾ��ӿ�
B��������ʱ0.1 mol/L HNO2(aq) pH��1����NaNO2��Һ�Լ���
C��NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l) ��H = -346kJ/mol
D��1 mol NH4���ڢٷ�Ӧ����1 mol NO2���ڢڷ�Ӧ��ʧ������֮��Ϊ1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱���з�̨��������ѧ��ͳһ��ϰ��һ����ѧ�Ծ��������棩 ���ͣ������
�п��Ľ���Na��¶�ڿ����У���仯�������£�

��1����Ӧ��ķ�Ӧ�����������仯�Ĺ�ϵ���£�

�� ��Ӧ�� �ǡ� ����Ӧ������ȡ������ȡ������ж������ǡ�������
�� 1 mol Na(s)ȫ��������Na2O(s)���Ȼ�ѧ����ʽ�ǡ�������
��2����Ӧ����Na2O��ˮ�ķ�Ӧ�������ĵ���ʽ�� ��
��3����ɫ��ĩΪNa2CO3����������ˮ����Ϊ0.1 mol/L Na2CO3��Һ������˵����ȷ���� ������ĸ����
A�������¶ȣ���Һ��pH����
B��c(OH��)��c (H��)��c (HCO3��)��2 c (H2CO3)
C����������NaOH���壬c (CO32�D)��c (Na��)������
D��c (Na��) > c (CO32�D) > c (HCO3�D) > c(OH�D) > c (H��)
��4�� �Ƶ�ص��о�������һ���̶��Ͽɻ��������Դ��ȱ�����ĵ�ط�չ�������⡣
�� �Ʊ�﮻��ã���ԭ�ӽṹ����ԭ��_______��
�� ZEBRA �����һ���Ƶ�أ��ܷ�ӦΪNiCl2 + 2Na  Ni + 2NaCl����������Ӧʽ��_____��
Ni + 2NaCl����������Ӧʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���Ϻ���������������ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1mol/L������6����Һ��pHֵ��
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
����˵��������У���ȷ����
A������������̼ͨ��NaClO��Һ�У�2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B�������� HCN����̼������Һ�� HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C���������������ǿ������˳��Ϊ��CO32����CN����HCO3����CH3COO��
D�������µ��볣����Ki2(H2CO3)��Ki(C6H5OH)��Ki(HCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���Ϻ�����㡢�ɽ�����ɽ����������ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʶ����н�ǿ����ˮ�ԡ���ʹϡ�����ΪŨ���ᣬ����ʹ�õ��Լ���
A��Ũ���� B������������ C����ˮ����þ D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com