
| A. | ①② | B. | ③ | C. | ⑤ | D. | ②④ |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.50 mol•L-1 盐酸,0.50 mol•L-1 NaOH溶液,100 mL量筒1个 | |
| B. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,100 mL量筒2个 | |
| C. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒1个 | |
| D. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
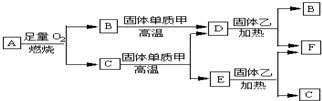
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- | |
| B. | 无色透明的溶液中:Ba2+、H+、MnO4-、Br- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L SO3中含有O数目为3.0NA | |
| B. | 常温常压下,12.2 gNaHSO4中含有离子总数为0.3NA | |
| C. | 在1 L 0.1 mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com