
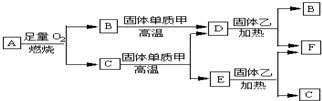
 .
.分析 气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中常见的气体,即C为非气体,A能燃烧生成B和C,则A通常含有碳、氢两种元素,C为水,B为二氧化碳,单质甲为碳,B与碳反应生成D为一氧化碳,固体乙为某金属氧化物,F为某金属单质,根据C与碳反应生成一氧化碳和E,E和固体乙发生氧化还原生成金属单质和C,可判断C为水,E为氢气,水与碳在高温下反应生成一氧化碳和氢气,固体乙为铜和或铁的氧化物,能被氢气或一氧化碳还原生成金属单质和水或一氧化碳,符合题中各物质转化关系,所以X为碳元素,Y为氢元素,据此答题.
解答 解:气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中常见的气体,即C为非气体,A能燃烧生成B和C,则A通常含有碳、氢两种元素,C为水,B为二氧化碳,单质甲为碳,B与碳反应生成D为一氧化碳,固体乙为某金属氧化物,F为某金属单质,根据C与碳反应生成一氧化碳和E,E和固体乙发生氧化还原生成金属单质和C,可判断C为水,E为氢气,水与碳在高温下反应生成一氧化碳和氢气,固体乙为铜和或铁的氧化物,能被氢气或一氧化碳还原生成金属单质和水或一氧化碳,符合题中各物质转化关系,所以X为碳元素,Y为氢元素,
(1)若A为两组分混合气体,且X与Y的质量比等于2,由于在气态碳、氢化合物中,甲烷中的碳、氢质量比是3:1,为最小,如果A中C与H的质量比小于3,则气体A中肯定含有H2,若另一种气体是甲烷,设氢气物质的量为x,甲烷的物质的量为y,则有$\frac{12y}{4y+2x}$=2,所以x:y=1:1,根据体积分数等于物质的量的分数可知甲烷在混合气中所占的体积分数为50%,CH4和Cl2在光照条件下发生取代反应,可以生成CH3Cl、CH2Cl2、CHCl3、CCl4,同时每个反应都生成氯化氢,根据各个取代反应的方程式可知1mol的Cl2生成1molHCl,
故答案为:H2;50%;HCl;1mol;
(2)若气体A的分子为直线型结构,且X与Y两元素的质量比在数值上等于X的相对原子质量,则A为乙炔,X为碳元素,X元素位于周期表的位置为第二族周期ⅣA,乙炔的电子式为 ,乙炔在空气中燃烧会有浓烟,应为生成了碳,假定A中X的物质的量分数的1/3转化成这种烟,另外2/3转化成一种有毒的气体,应为一氧化碳,根据元素守恒可知,该反应的化学方程式为6CH≡CH+7O2$\frac{\underline{\;点燃\;}}{\;}$4C+8CO+6H2O,
,乙炔在空气中燃烧会有浓烟,应为生成了碳,假定A中X的物质的量分数的1/3转化成这种烟,另外2/3转化成一种有毒的气体,应为一氧化碳,根据元素守恒可知,该反应的化学方程式为6CH≡CH+7O2$\frac{\underline{\;点燃\;}}{\;}$4C+8CO+6H2O,
故答案为:第二族周期ⅣA; ;6CH≡CH+7O2$\frac{\underline{\;点燃\;}}{\;}$4C+8CO+6H2O.
;6CH≡CH+7O2$\frac{\underline{\;点燃\;}}{\;}$4C+8CO+6H2O.
点评 本题考查了碳及其化合物性质分析判断,掌握物质的组成和物质性质是解题关键,题目难度中等,答题时要学会根据各物质的转化关系综合分析进行物质推断.


科目:高中化学 来源: 题型:选择题
| A. | 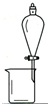 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. | 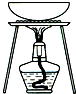 从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 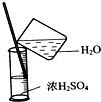 稀释浓硫酸 稀释浓硫酸 | D. |  工业酒精制备无水酒精 工业酒精制备无水酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,NaClO属于离子(离子、共价)化合物.
,NaClO属于离子(离子、共价)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最合理的方法是( )
最合理的方法是( )| A. | CH3CH3与Cl2取代 | B. | CH2═CH2与HCl加成 | ||
| C. | CH2═CH2与Cl2加成 | D. | CH3CH2Cl与Cl2取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 60mL | C. | 20mL | D. | 0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫体现还原性,做还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增加Y的用量 | C. | 减小压强 | D. | 使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com