
【题目】硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
(1)写出基态Zn原子的价电子排布式__,基态S原子核外未成对电子数为__。
(2)ZnSO4中三种元素的电负性由大到小的顺序为__,SO42-的立体构型为__,其中S的杂化轨道类型为__。
(3)硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有__。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
(4)根据下列锌卤化物的熔点和溶解性,分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因__。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5)钾晶体晶胞结构如图所示,距离最近的两个钾原子距离为acm,阿伏加德罗常数为NA。
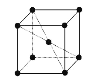
①钾原子核外运动状态不同的电子数是___。
②钾晶体的密度是___。
【答案】3d104s2 2 O、S、Zn 正四面体形 sp3 a ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高 19 ![]()
【解析】
(1)Zn位于周期表中第四周期,第IIB族,结合Zn的核外电子排布式解答,S是氧族元素,价电子排布式为3s23p4,p轨道上有未成对电子;
(2)ZnSO4中三种元素为Zn,S,O,非金属元素的电负性普遍大于金属元素,根据VSEPR理论和杂化轨道理论判断![]() 的立体构型,等电子原理是原子数相同的条件下,原子的价电子数相同,据此解答;
的立体构型,等电子原理是原子数相同的条件下,原子的价电子数相同,据此解答;
(3)[Zn(NH3)4]SO4为配合物,其溶于水后完全电离出[Zn(NH3)4]2+和![]() ,根据离子中存在的化学键判断;
,根据离子中存在的化学键判断;
(4)乙醇、乙醚都是有机溶剂,根据相似相溶原理,溶解的应是结构相似的物质,也就是溶质分子的分子间力与溶剂分子之间的分子间力越相似,越易互溶;分子晶体组成相似,随着相对分子质量增大,分子间作用力增强,熔沸点上升;
(5)①钾原子核电荷数为19,原子核外有19个电子;
②晶胞中顶点钾原子和中心钾原子距离最近,且两个钾原子距离为acm,则晶胞的边长为![]() cm,晶胞的体积为
cm,晶胞的体积为![]() cm3,晶胞中K原子数目为8×
cm3,晶胞中K原子数目为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,据此计算钾晶体的密度。
g,据此计算钾晶体的密度。
(1)基态Zn原子在元素周期表中所处的位置是第四周期,第IIB族,基态Zn的价电子排布式为3d104s2;S元素为氧族元素,价电子排布式为3s23p4,3p轨道排4个电子,其中只有一对是成对的,剩余2个为单电子,因此未成对电子数为2;
(2)ZnSO4中三种元素为Zn,S,O,非金属元素的电负性普遍大于金属元素,同主族元素从上到下,电负性值逐渐减少,因此电负性顺序为O>S>Zn;对于![]() ,根据VSEPR理论,
,根据VSEPR理论,![]() 中,与中心S原子的成键原子数为BP=4,孤电子对数为
中,与中心S原子的成键原子数为BP=4,孤电子对数为![]() =0,则价电子对数为4+0=4,根据杂化轨道理论可知S原子为sp3杂化,则
=0,则价电子对数为4+0=4,根据杂化轨道理论可知S原子为sp3杂化,则![]() 的立体构型为正四面体形;
的立体构型为正四面体形;
(3)[Zn(NH3)4]SO4为配合物,其溶于水后完全电离出[Zn(NH3)4]2+和![]() ,则溶液中不存在离子键,H2O、
,则溶液中不存在离子键,H2O、![]() 和NH3内存在的作用力为共价键,[Zn(NH3)4]2+内存在配位键,水分子间存在范德华力和氢键,
和NH3内存在的作用力为共价键,[Zn(NH3)4]2+内存在配位键,水分子间存在范德华力和氢键,![]() 中存在共价键,综上,不存在的作用力是离子键,故答案为a;
中存在共价键,综上,不存在的作用力是离子键,故答案为a;
(4)ZnCl2,ZnBr2,ZnI2,组成与结构相似,在乙醇乙醚溶剂中能溶解,表明均为分子晶体,对于组成和结构相似的分子晶体,随着相对分子质量的增加,范德华力增强,熔沸点也相应升高;
(5)①钾原子核电荷数为19,原子核外有19个电子,钾原子核外运动状态不同的电子数是19;
②晶胞中顶点钾原子和中心钾原子距离最近,且两个钾原子距离为acm,则晶胞的边长为![]() cm,晶胞的体积为
cm,晶胞的体积为![]() cm3,晶胞中K原子数目为8×
cm3,晶胞中K原子数目为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,钾晶体的密度为
g,钾晶体的密度为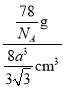 =
=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,图甲表示反应速率(v)与温度(T)的关系、图乙表示T1时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
2SO3(g)ΔH<0,图甲表示反应速率(v)与温度(T)的关系、图乙表示T1时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
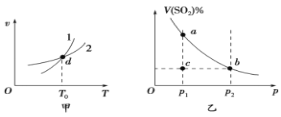
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点时,混合气体的平均摩尔质量不再改变
C.图乙中,a、b两点的反应速率:va>vb
D.图乙中,c点的正、逆反应速率:v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种苯的同系物0.1mol 在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1②1∶1∶2∶6③3∶2④3∶2∶2∶2∶1,请分别推断出其对应的结构:①_______;②_________________;③___________;④___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
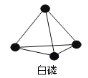
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中由水电离出的c(H+)=1×10-11mol/L,该溶液不可能是( )
A. 硫酸氢钠溶液 B. 醋酸钠溶液 C. 氢氧化钠溶液 D. 二氧化硫水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 可以写成
可以写成![]() 。有机物A的结构如下图所示,请回答:
。有机物A的结构如下图所示,请回答:

(1)有机物A分子所含官能团的名称为__________________。
(2)1mol A最多与____mol H2在一定条件下反应可生成环烃B。
(3)有机物A的分子式为_____________________________。
(4)有机物C是A的同分异构体,属于芳香烃,且C在一定条件下可发生聚合反应,生成高分子化合物D。则C的结构简式为______________,D的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在医药工业中,有机物 G是一种合成药物的中间体 ,其合成路线如图所示 :
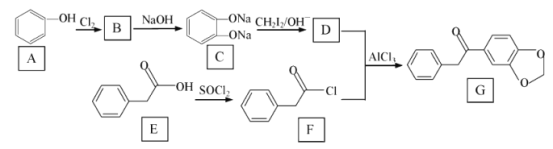
已知:R1ONa+R2X→R1OR2+NaX(R1与 R2代表苯环或烃基、X 代表卤素原子)
RCOOH+SOCl2(液体)→RCOCl+HCl↑+SO2↑
回答下列问题:
(1)A 与C在水中溶解度更大的是 _________ , G 中官能团的名称是 ___________。
(2)E→F 的有机反应类型是 ________ ,F 的分子式为______________。
(3)由A→B反应的化学方程式为 ___________________。
(4)物质D的结构简式为 _________________。
(5)B→C 反应中加入NaOH 的作用是________________。
(6)写出一种符合下列条件的G的同分异构体 _________________ 。
①与G的苯环数相同;②核磁共振氢谱有5 个峰;③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
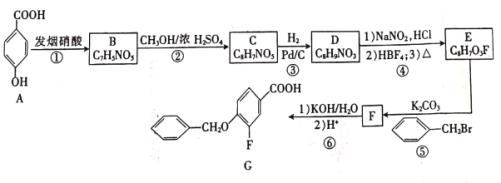
【题目】我国研究人员发现茶叶中的EGCG能有效阻断新冠病毒S蛋白与人体ACE2受体的结合。制备EGCG的中间体G的一种合成路线如下:
已知: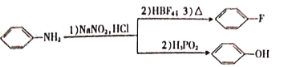
回答下列问题:
(1)G中官能团的名称是______。
(2)反应①的反应类型是____________。
(3)F与KOH溶液反应的化学方程式为__________________。
(4)芳香族化合物X与D互为同分异构体,其中属于硝酸酯(![]() )的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
)的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
(5)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。下列关于EGCG(结构简式如图)的说法错误的是______(填标号)。
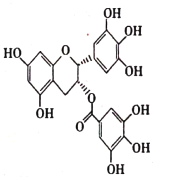
A.含有两种官能团
B.分子中含有两个手性碳原子
C.能与![]() 溶液发生显色反应
溶液发生显色反应
D.1 mol EGCG与NaOH溶液反应,最多消耗8 mol NaOH
(6)1,4—苯并二恶烷(![]() )是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
)是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com