
【题目】在医药工业中,有机物 G是一种合成药物的中间体 ,其合成路线如图所示 :
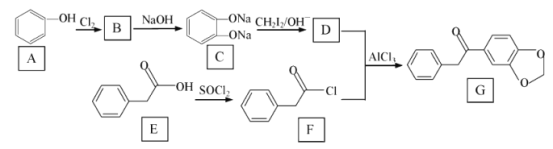
已知:R1ONa+R2X→R1OR2+NaX(R1与 R2代表苯环或烃基、X 代表卤素原子)
RCOOH+SOCl2(液体)→RCOCl+HCl↑+SO2↑
回答下列问题:
(1)A 与C在水中溶解度更大的是 _________ , G 中官能团的名称是 ___________。
(2)E→F 的有机反应类型是 ________ ,F 的分子式为______________。
(3)由A→B反应的化学方程式为 ___________________。
(4)物质D的结构简式为 _________________。
(5)B→C 反应中加入NaOH 的作用是________________。
(6)写出一种符合下列条件的G的同分异构体 _________________ 。
①与G的苯环数相同;②核磁共振氢谱有5 个峰;③能发生银镜反应
【答案】C 羰基(或酮基)、醚键 取代反应 C8H7OCl 或 C8H7ClO ![]()
 催化剂、促进水解
催化剂、促进水解 ![]()
【解析】
![]() 与氯气反应生成
与氯气反应生成![]() ,
,![]() 在氢氧化钠溶液作用下反应生成
在氢氧化钠溶液作用下反应生成![]() ,根据信息
,根据信息![]() 与CH2I2反应生成
与CH2I2反应生成 ,根据信息E和SOCl2反应生成F,
,根据信息E和SOCl2反应生成F, 与F反应生成G。
与F反应生成G。
⑴A是苯酚在水中溶解度不大,C为盐,在水解溶解度大,因此A与C在水中溶解度更大的是C,根据G的结构得到G中官能团的名称是羰基、醚键;故答案为:C;羰基(或酮基)、醚键。
⑵E→F是—OH变为—Cl,Cl取代羟基,因此有机反应类型是取代反应,根据F的结构简式得到F的分子式为C8H7OCl或C8H7ClO;故答案为:取代反应;C8H7OCl或C8H7ClO。
⑶由A→B反应是氯原子取代羟基的邻位上的氢,其化学方程式为![]() ;故答案为:
;故答案为:![]() 。
。
⑷根据D和F生成G的反应得到物质D的结构简式为 ;故答案为:
;故答案为: 。
。
⑸根据B的结构(![]() ),加入NaOH溶液得到C(
),加入NaOH溶液得到C(![]() ),反应中加入NaOH的作用是催化剂、促进水解;故答案为:催化剂、促进水解。
),反应中加入NaOH的作用是催化剂、促进水解;故答案为:催化剂、促进水解。
⑹①与G的苯环数相同;②核磁共振氢谱有5个峰,说明对称性较强;③能发生银镜反应说明有醛基或则甲酸酯,则符合条件的G的同分异构体![]() ;故答案为:
;故答案为:![]() 。
。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.苯和乙苯 B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙酸和乙二酸
D.35Cl和37Cl E.乙酸和乙二酸
(1)互为同位素的是___;
(2)互为同系物的是___;
(3)互为同素异形体的是__;
(4)互为同分异构体的是___;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
(1)写出基态Zn原子的价电子排布式__,基态S原子核外未成对电子数为__。
(2)ZnSO4中三种元素的电负性由大到小的顺序为__,SO42-的立体构型为__,其中S的杂化轨道类型为__。
(3)硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有__。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
(4)根据下列锌卤化物的熔点和溶解性,分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因__。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5)钾晶体晶胞结构如图所示,距离最近的两个钾原子距离为acm,阿伏加德罗常数为NA。
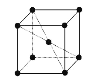
①钾原子核外运动状态不同的电子数是___。
②钾晶体的密度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
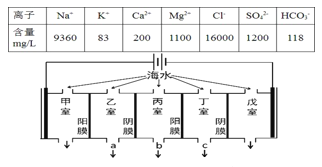
A.甲室的电极反应式为:2Cl--2e-=Cl2↑
B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为b
D.通过甲室阳膜的离子的物质的量为2mol时,戊室收集到22.4L(标准状况下)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)按要求书写下列物质的系统命名:
①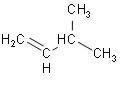 ,将其在催化剂存在下完全与氢气加成所得的产物____;
,将其在催化剂存在下完全与氢气加成所得的产物____;
②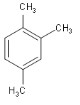 ____。
____。
(2)书写下列物质的结构简式:
①分子式为C5H10的烃存在顺反异构,写出它的顺反两种异构体的结构简式:_____;
②分子式为C9H12的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式:_____。
(3)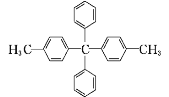 共线的碳原子最多有____个。
共线的碳原子最多有____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
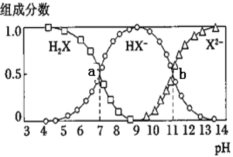
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有![]() 、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
A.只有![]() B.Mg2+ 、Fe2+C.
B.Mg2+ 、Fe2+C.![]() 、Fe2+D.全部
、Fe2+D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定, 极易被氧气氧化。醋酸亚铬水合物{ [Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示:
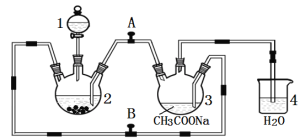
制备过程中发生的反应如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g);
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO—(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)仪器1的名称是 , 所盛装的试剂是 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是 。
(3)实验开始生成H2气后, 为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应 阀门A、 阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是 , 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,请计算该实验所得产品的产率 。
(6)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2白色沉淀现象。则在1、2、3中应装入的试剂依次为 、 、 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿太阳能电池具有转化效率高、低成本等优点,是未来太阳能电池的研究方向。回答下列问题:
(1)下列状态的钙中,电离最外层一个电子所需能量最大的是__________(填字母标号)。
A.[Ar]4s1 B.[Ar]4s2 C.[Ar]4s14p1 D.[Ar]4p1
(2)基态钛原子的核外价电子轨道表达式为____________。
(3)一种有机金属卤化钙钛矿中含有NH2-CH=NH2+,该离子中氮原子的杂化类型为___________,其对应分子NH2-CH=NH的熔沸点高于CH3CH2CH=CH2的熔沸点的原因为__________。
(4)一种无机钙钛矿CaxTiyOz的晶体结构如图所示,则这种钙钛矿化学式为___________,已知Ca和O离子之间的最短距离为a pm,设阿伏加德罗常数的值为NA,则这种钙钛矿的密度是___________g·cm-3(列出计算表达式)。
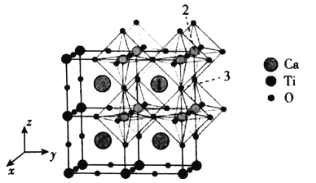
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,
,![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com