
| A. | 在光照条件下,甲烷与氯水发生取代反应 | |
| B. | 有机反应中,卤代、硝化、磺化、酯化、水解反应等不完全是取代反应 | |
| C. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 | |
| D. | 若烃中碳、氢元素的质量分数相同.它们必定是同系物 |
分析 A.甲烷与氯水不反应;
B.卤代、硝化、磺化、酯化、水解反应中均为原子或原子团被其它原子或原子团取代;
C.O的非金属性强,乙醇与水分子之间易形成氢键;
D.乙炔、苯中碳、氢元素的质量分数相同,二者结构不同.
解答 解:A.甲烷与氯水不反应,光照下甲烷与氯气发生取代反应,故A错误;
B.卤代、硝化、磺化、酯化、水解反应中均为原子或原子团被其它原子或原子团取代,则均属于取代反应,故B错误;
C.O的非金属性强,乙醇与水分子之间易形成氢键,所以乙醇可与水以任意比例混溶,故C正确;
D.乙炔、苯中碳、氢元素的质量分数相同,二者结构不同,不是同系物,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及同系物判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5+3-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物的水化物能溶于稀氨水 | |
| D. | Z的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
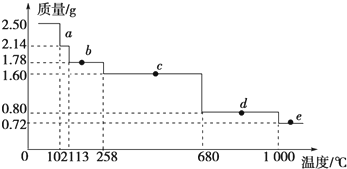
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.125mol | |
| B. | 可能小于0.125mol,也可能大于0.125mol | |
| C. | 小于0.125mol | |
| D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的K0H、Cl2和H2都是电解质 | |
| B. | 反应②属于离子反应 | |
| C. | 若反应①消耗7.45gKCl,可以制备标准状况下4.48L氯气 | |
| D. | 反应②中氧化剂和还原剂的质量之比是1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用KOH溶液鉴别SO3(g)和SO2 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com