
【题目】磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣![]() 主要成分为
主要成分为![]() ,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
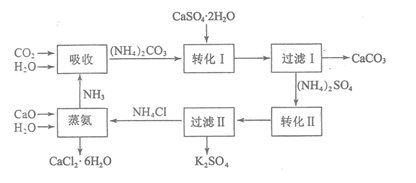
请回答以下问题:
![]() 为了提高原料的利用率,吸收流程中通入
为了提高原料的利用率,吸收流程中通入![]() 和
和![]() 的先后顺序最好为______。
的先后顺序最好为______。
![]() 碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
![]() 工艺流程中除了所给出的
工艺流程中除了所给出的![]() 、
、![]() 、
、![]() 、
、![]() 等原料外,在转化Ⅱ的过程中还需要加入______原料。
等原料外,在转化Ⅱ的过程中还需要加入______原料。
![]() 过滤Ⅱ后所得滤液
过滤Ⅱ后所得滤液![]() 溶液,确认其中含有
溶液,确认其中含有![]() 的方法是:______;
的方法是:______;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,选择的依据是因为______
是目前常用的无机储热材料,选择的依据是因为______![]() 选填序号
选填序号![]() ;
;
A.熔点较低![]() 熔化
熔化![]()
![]() 能导电
能导电![]() 能制冷
能制冷![]() 无毒
无毒
![]() 已知不同温度下
已知不同温度下![]() 在100g水中达到饱和时溶解的量如下表:
在100g水中达到饱和时溶解的量如下表:
温度 | 0 | 20 | 60 |
|
|
|
|
![]() 时
时![]() 的饱和溶液
的饱和溶液![]() 冷却到
冷却到![]() ,可析出
,可析出![]() 晶体______g。
晶体______g。
![]() 上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______
上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______![]() 均填化学式
均填化学式![]() 。
。
【答案】先通入![]() ,后通入
,后通入![]()
![]() KCl 取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子 ad
KCl 取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子 ad ![]()
![]()
![]()
【解析】
![]() 从
从![]() 在水中的溶解度不大、而
在水中的溶解度不大、而![]() 极易溶于水来分析;
极易溶于水来分析;
![]() 根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤,得到碳酸钙与硫酸铵;
根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤,得到碳酸钙与硫酸铵;![]() 微溶且为悬浊液、
微溶且为悬浊液、![]() 不溶,所以二者在离子方程式中均不拆;然后配平即可;
不溶,所以二者在离子方程式中均不拆;然后配平即可;
![]() 根据原子守恒和制备物质过程中不引入新杂质离子的原则分析;
根据原子守恒和制备物质过程中不引入新杂质离子的原则分析;
![]() 先除杂,再用稀硝酸酸化的硝酸银溶液检验;
先除杂,再用稀硝酸酸化的硝酸银溶液检验;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关;
是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关;
![]() 根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算;
根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算;
![]() 根据绿色化学的特点进行分析.碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等
根据绿色化学的特点进行分析.碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等![]() 原子利用率高,没有有害物质排放到环境中。
原子利用率高,没有有害物质排放到环境中。
![]() 氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为
氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为![]() ,故答案为:先通入
,故答案为:先通入![]() ,后通入
,后通入![]() ;
;
![]() 根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤得到碳酸钙与硫酸铵,
根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤得到碳酸钙与硫酸铵,![]() 微溶且为悬浊液、
微溶且为悬浊液、![]() 不溶,所以在离子方程式中均不拆;然后配平即可,故答案为:
不溶,所以在离子方程式中均不拆;然后配平即可,故答案为:![]() ;
;
![]() 由流程图可知,加入
由流程图可知,加入![]() 、
、![]() 、
、![]() 、
、![]() 反应,在过滤Ⅱ后滤液中有硫酸钾,制备的产物中含有氯元素,根据原子守恒和不引入杂质的原则,还需要补充KCl溶液,故答案为:KCl;
反应,在过滤Ⅱ后滤液中有硫酸钾,制备的产物中含有氯元素,根据原子守恒和不引入杂质的原则,还需要补充KCl溶液,故答案为:KCl;
![]() 首先要除去杂质硫酸根离子,再取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子,故答案为:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
首先要除去杂质硫酸根离子,再取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子,故答案为:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关,故答案为:ad;
是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关,故答案为:ad;
![]() 根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算,
根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算,![]() :
:![]() :x
:x ![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由绿色化学的特点可知,碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙;氨在工艺中循环使用等
由绿色化学的特点可知,碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙;氨在工艺中循环使用等![]() 原子利用率高,没有有害物质排放到环境中
原子利用率高,没有有害物质排放到环境中![]() ,故答案为:
,故答案为:![]() ;
;![]() .
.


科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
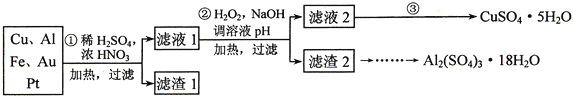
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法: |
方法Ⅲ | 用肼 |
![]() 第
第![]() 步Cu与混酸反应的离子方程式为______
步Cu与混酸反应的离子方程式为______![]() 得到滤渣1的主要成分为______。
得到滤渣1的主要成分为______。
![]() 第
第![]() 步中加入
步中加入![]() 的作用是______,使用
的作用是______,使用![]() 的优点是______;调溶液pH的目的是______。
的优点是______;调溶液pH的目的是______。
![]() 简述第
简述第![]() 步由滤液2得到
步由滤液2得到![]() 的方法是______。
的方法是______。
![]() 由滤渣2制取
由滤渣2制取![]() ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣![]() 酸浸液
酸浸液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理。
![]() 用滴定法测定
用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20mL浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )

A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为_________。终点时消耗标准溶液25mL,硝酸银样品纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关它的叙述不正确的是
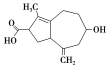
A.分子式为C13H18O3
B.能发生酯化反应、取代反应、还原反应、中和反应、消去反应
C.能使酸性高锰酸钾溶液褪色
D.1 mol该物质最多可以与3 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/LB.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com