
| A、升高温度可使用该反应的逆反应速率降低 |
| B、使用高效催化剂可有效提高正反应速率 |
| C、反应达到平衡后,v(NO)≠v(N2) |
| D、增大压强有利于平衡向正反应方向进行 |


科目:高中化学 来源: 题型:
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:
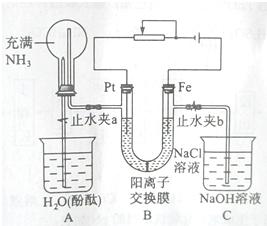
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室将Na2SO3溶液直接加热蒸发结晶可得到Na2SO3晶体 |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
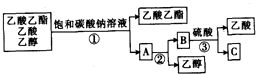
| A、①蒸馏 ②过滤 ③分液 |
| B、①分液 ②蒸馏 ③蒸馏 |
| C、①蒸馏 ②分液 ③分液 |
| D、①分液 ②蒸馏 ③结晶、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自行车钢架生锈主要是电化学腐蚀所致 |
| B、玻璃容器内壁中沉积的CaSO4可用Na2CO3溶液浸泡后再加酸除去 |
| C、在工业合成氨中温度越高反应速度越快,越有利于提高N2的转化率 |
| D、生活中使用明矾净水,是利用了Al3+水解生成的Al(OH)3胶体吸附杂质的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甘油 | B、吗啡 | C、冰毒 | D、海洛因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com