
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |


科目:高中化学 来源: 题型:
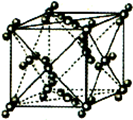 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
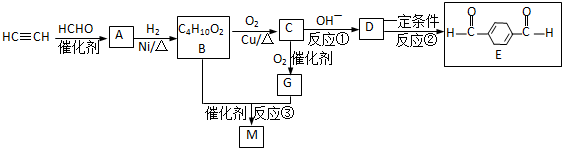
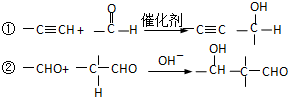
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤①③⑥ |
| B、⑤④②①③⑥ |
| C、⑤④②③①⑥ |
| D、②④⑤①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、.①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度可使用该反应的逆反应速率降低 |
| B、使用高效催化剂可有效提高正反应速率 |
| C、反应达到平衡后,v(NO)≠v(N2) |
| D、增大压强有利于平衡向正反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com