
H2O2是重要的化学试剂,在实验室和生产实际中应用广
泛。
(1)H2O2不稳定,其生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
① 2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O
② (填离子方程式)。
(2)H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式__________________。
(3)H2O2在使用中通常不会带来污染。
①工业上利用Cl2 + H2O2 = 2HCl + O2除氯,在此反应中被氧化的物质是______________。
②消除某废液中的氰化物(含CN-),完成下列反应:CN- + H2O2 + H2O=____________ + NH3↑
(4)实验室常用酸性KMnO4溶液测定H2O2的浓度。取10.00 mL H2O2溶液样品(密度近似为1g/mL)于锥形瓶中,加水到50.00 mL,当滴入0.10 mol/L KMnO4 溶液40.00 mL后,恰好完全反应。则原样品中H2O2的质量分数是_______________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
两种金属混合物共15g,投入足量的盐酸中,充分反应得
1g H2,则原混合物组成中肯定不能为下列的 ( )
A.Mg、Ag B.Fe、Mg C.Al、Cu D.Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的每步转化通过一步反应能实现的
是( )
A.Al → Al2O3→ Al(OH)3 → NaAlO2
B.Si → SiO2 → H2SiO3 → Na2SiO3
C.N 2 → NO→ NO2 → HNO3
2 → NO→ NO2 → HNO3
D.S → SO3 → H2SO4 → MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
常根据物质的组成、状态、性能等对物质进行分类。下列分
类中,前者能够包含后者的是( )
A.酸性氧化物 、非金属氧化物 B.胶体、分散系
、非金属氧化物 B.胶体、分散系
C.含氧酸、酸 D.化合物、非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g
H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④b.密度②>③>④>①
c.质量②>③>①>④d.氢原子个数①>③>④>②
A.abc B. bcd C. abcd D. acd
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较顺序中,不正确的是( )
|
| A. | 热稳定性:NH3>PH3>SiH4 |
|
| B. | 微粒半径:K+>Na+>Mg2+>Al3+ |
|
| C. | 氢键的作用能F﹣H…F>O﹣H…O>N﹣H…N |
|
| D. | 电负性:F>N>O>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一配制一定浓度的醋酸溶液
(1)取冰醋酸配制250mL0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 .
实验二 探究浓度对醋酸电离程度的影响
测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L﹣1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(2)表中数据是利用 (填仪器名称)测得的,根据表中数据,可以得出醋酸是 (填“强电解质”或“弱电解质”),你得出此结论的依据是
(3)已知10﹣2.73=1.86×10﹣3,利用此数据可以求得0.2000mol•L﹣1醋酸溶液的电离度α=
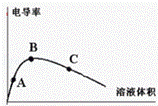
(4)用水稀释冰醋酸,电导率随加入水量的变化如右图所示A、B、C三点的电离度由大到小排列:
实验三 探究 对醋酸电离程度的影响
某同学利用传感器技术(如右下图),将20mL,0.1mol/L醋酸溶液放置在可加热磁力搅拌器上,并用pH传感器测量溶液的pH,利用电脑处理实验数据并作图(如下图)
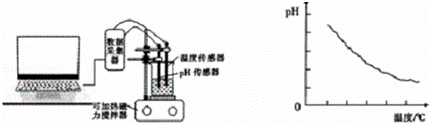
(5)由数据处理结果可以得到的结论是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com