
ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�飮
ʵ��һ����һ��Ũ�ȵĴ�����Һ
��1��ȡ����������250mL0.2mol/L�Ĵ�����Һ����0.2mol/L�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������250mL 0.2mol/L������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�����������������������
ʵ��� ̽��Ũ�ȶԴ������̶ȵ�Ӱ��
�ⶨ25��ʱ��ͬŨ�ȵĴ����pH��������£�
| ����Ũ�ȣ�mol•L﹣1�� | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
��2�������������������������������ƣ���õģ����ݱ������ݣ����Եó��������������ǿ����ʡ���������ʡ�������ó��˽��۵�����������
��3����֪10﹣2.73=1.86��10﹣3�����ô����ݿ������0.2000mol•L﹣1������Һ�ĵ���Ȧ�=����
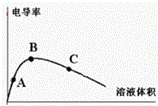
��4����ˮϡ�ͱ����ᣬ�絼�������ˮ���ı仯����ͼ��ʾA��B��C����ĵ�����ɴ�С���У�����
ʵ���� ̽�������Դ������̶ȵ�Ӱ��
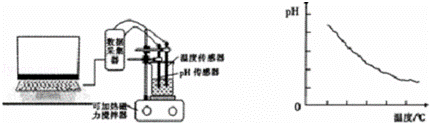
ijͬѧ���ô�����������������ͼ������20mL��0.1mol/L������Һ�����ڿɼ��ȴ����������ϣ�����pH������������Һ��pH�����õ��Դ���ʵ�����ݲ���ͼ������ͼ��
��5�������ݴ���������Եõ��Ľ�����������
���㣺
�Ƚ�ǿ������ʵ�ʵ�飮
ר�⣺
ʵ������⣮
������
��1����������һ�����ʵ���Ũ�ȵ���Һ�IJ���ȷ��ʵ��������
��2������pHֵ�������0.01����Ӧ��ʹ��pH�Ʋ�����ǿ�������ȫ���룬������ʲ��ֵ��룬����Ϊ������ʣ���Һ�в��ֵ���������ӣ�
��3�����ݵ���ȵı���ʽ���������ݽ��м��㣻
��4����ҺԽϡ��Խ�ٽ�������룬����Һ�������ӵ����ʵ���Խ����̶�Խ��
��5����������ͼ�����ݿ�֪����ʵ��̽�������¶ȶԴ������̶ȵ�Ӱ�죻���ݴ���ĵ���Ϊ���ȹ��̵ó����ۣ�
���
�⣺��1������250mL 0.2mol/L������Һ�����У��������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡ�����ᣬ�ѱ����ᵹ���ձ������ܽ⣬��ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ���������в��������ձ�����ͷ�ιܡ�250mL����ƿ����Ͳ��
�ʴ�Ϊ����ͷ�ιܣ�250mL����ƿ��
��2���ⶨ��pH�����Ҫ����0.01������Ӧ��ʹ��pH���вⶨ��Һ��pH��������Ϊǿ�ᣬ����ȫ����������һԪ�ᣬ0.0100mol/L�Ĵ����PHӦΪ2����֪PHΪ3.38��˵������û����ȫ���������ᣬ
�ʴ�Ϊ��pH�ƣ�0.0100 mol/L �����pH����2�������ϡ��10��ʱ��pH�ı仯ֵС��l����
��3��0.2000mol•L﹣1������Һ��������Ũ��Ϊ��10﹣2.73mol/L=1.86��10﹣3mol/L�����Դ���ĵ����Ϊ��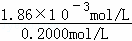 ��100%=0.93%��
��100%=0.93%��
�ʴ�Ϊ��0.93%��
��4����ҺԽϡ��Խ�ٽ�������룬����Һ�������ӵ����ʵ���Խ����̶�Խ������A��B��C����ĵ�����ɴ�С����Ϊ��C��B��A��
�ʴ�Ϊ��C��B��A��
ʵ����������ͼ��������֪����ʵ����̽���¶ȶԴ������ȵ�Ӱ�죬
�ʴ�Ϊ���¶ȣ�
��5������ͼ���֪�������¶����ߣ�������Һ��pH��С��˵�������¶ȣ���Һ��������Ũ��������ĵ���̶�������
�ʴ�Ϊ���¶�Խ�ߣ�����ĵ���̶�Խ��
������
���⿼��������Һ����������������ʵĵ����֪ʶ����Ŀ�Ѷ��������������Դ�ע������������Һ�IJ��衢���������Լ�������ע����������⣬��ȷ�����������Һ�в��ֵ��뼰Ӱ��������ʵ�������أ�
��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H2O2����Ҫ�Ļ�ѧ�Լ�����ʵ���Һ�����ʵ����Ӧ�ù�
����
��1��H2O2���ȶ�������������Ҫ�ϸ�������Fe2+��Fe3+������ᷢ������������Ӧ���ӿ���ֽ⣬��Fe2+��Fe3+���Ե������ֲ��䡣
�� 2Fe2+ + H2O2 + 2H+��2Fe3+ + 2H2O
�� �������ӷ���ʽ����
��2��H2O2��ˮ��Һ�������ԣ�д��һ����������ȡH2O2�Ļ�ѧ����ʽ__________________��
��3��H2O2��ʹ����ͨ�����������Ⱦ��
�ٹ�ҵ������Cl2 + H2O2 = 2HCl + O2���ȣ��ڴ˷�Ӧ�б�������������______________��
������ij��Һ�е��軯���CN-����������з�Ӧ��CN- + H2O2 + H2O��____________ + NH3��
��4��ʵ���ҳ�������KMnO4��Һ�ⶨH2O2��Ũ�ȡ�ȡ10.00 mL H2O2��Һ��Ʒ���ܶȽ���Ϊ1g/mL������ƿ�У���ˮ��50.00 mL��������0.10 mol/L KMnO4 ��Һ40.00 mL��ǡ����ȫ��Ӧ����ԭ��Ʒ��H2O2������������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йؾ��������˵���в���ȷ���ǣ�������
| �� | A�� | ��NaCl�����У���Na+�����Cl﹣�γ��������� |
| �� | B�� | ��NaCl�����У�ÿ������ƽ��ռ��4��Na+ |
| �� | C�� | ��CsCl�����У�ÿ������ƽ��ռ��8��Cs+ |
| �� | D�� | ͭ����Ϊ���������ѻ���ͭԭ�ӵ���λ��������һ��ͭԭ�����������ͭԭ�ӵĸ�����Ϊ12 |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и������ʷ�����ȷ���ǣ�������
| A | B | C | D | |
| ǿ����� | HF | HClO4 | Ba��OH��2 | ʳ��ˮ |
| ������� | Cu��OH��2 | NH3•H2O | CaCO3 | HClO |
| �ǵ���� | Cu | SO2 | ���� | H2O |
| �� | A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��´�ˮ��c��H+��=10﹣6mol/L�����¶���pH=5��������pH=9������������Һ��Ϻ�pH=7��������������Һ������֮��Ϊ��������
| �� | A�� | 2��99 | B�� | 1��1 | C�� | 1��99 | D�� | 1��100 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������ȷ���ǣ�������
�� A�� 3�������� B�� 1��1��3����������
�� C�� 2��2��4��4���ļ����� D�� 4����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����һ±���鲻�ܷ�����ȥ��Ӧ���ǣ�������
�� A�� CH3CH2Cl B�� ��CH3��2CHCl C�� ��CH3��3CCl D�� ��CH3��3CCH2Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ľ�Ǵ������������ǵ���ζ����ľ�Ǵ��Ľṹ��ʽΪCH2OH﹣CHOH﹣CHOH﹣CHOH﹣CH2OH�������й�ľ�Ǵ���˵������ȷ���ǣ�������
| �� | A�� | ��һ�ֵ��� | B�� | �ܷ���������Ӧ |
| �� | C�� | ���ܷ���ˮ�ⷴӦ | D�� | �ڿ�ǻ�в��ױ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������һ����Ҫ�����ʣ���������ȡ���ʺ�����ȣ�
��1��500��C��50Mpaʱ�����ݻ�ΪVL���ܱ������м���n mol N2��3n mol H2������t min��Ӧ�ﵽƽ���N2��ת����Ϊa���������������ѹǿ��Ӧǰ��ƽ��ʱ�ı�ֵΪ������t min����NH3��ʾ��������������mol/L��min
��2����ҵ�ϳɰ����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��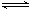 2NH3��g��+92.2kJ/mol
2NH3��g��+92.2kJ/mol
����ʾ������2mol NH3ʱ�ų�92.2KJ���ȣ����йؼ��ܣ�N��N��945.6kJ/mol��N﹣H��391.0kJ/mol����H﹣H����Ϊ����KJ/mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com