
| A. | 只有① | B. | ②和③ | C. | ③和④ | D. | ②和④ |
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
| A. | 2 min时H2O2的浓度c(H2O2)=0.314 mol/L | |
| B. | 0~4 min的平均反应速率v(H2O2)=3.75×10-2 mol/(L•min) | |
| C. | 0~10 min内,过氧化氢的分解速率逐渐加快 | |
| D. | 反应到6 min时,H2O2分解了50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢硫酸显弱酸性:H2S?2H++S2- | |
| B. | Na2CO3水溶液显弱碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铜电极电解饱和NaCl溶液:阳极反应式是:2Cl--2e-=Cl2↑ | |
| D. | 用稀硝酸洗去试管中的银镜:3Ag+NO3-+4H+=3Ag++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4. .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.| 化学式 | H2O | O2 | - |
| 物质的量(mol) | 0.05 | 0.00175 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 碘的四氯化碳溶液可用萃取的方法分离出四氯化碳 | |
| D. | 配制稀硫酸时,先向烧杯中注入适量蒸馏水,再缓慢注入浓硫酸,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 min时:c(SO3)+c(SO2)=1.0L/mol | |
| B. | 2 min 内:v(SO2)=0.25moL/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
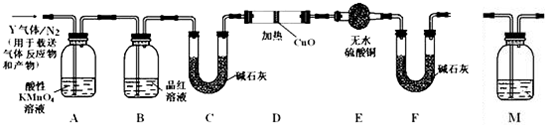
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com