
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
| A. | 2 min时H2O2的浓度c(H2O2)=0.314 mol/L | |
| B. | 0~4 min的平均反应速率v(H2O2)=3.75×10-2 mol/(L•min) | |
| C. | 0~10 min内,过氧化氢的分解速率逐渐加快 | |
| D. | 反应到6 min时,H2O2分解了50% |
分析 A.发生反应:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,2min时间内,生成氧气$\frac{0.0096L}{22.4L/mol}$≈4.29×10-4mol,△c(H2O2)=4.29×10-4mol×2÷0.01L=0.0858mol/L,起始浓度减去浓度变化量即为2min时浓度;
B.0~4 min,生成氧气$\frac{0.0168L}{22.4L/mol}$=7.5×10-4mol,△c(H2O2)=7.5×10-4mol×2÷0.01L=0.015mol/L,再根据v=$\frac{△c}{△t}$计算v(H2O2);
C.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢;
D.根据生成的氧气计算分解的过氧化氢,H2O2分解率=(分解的H2O2物质的量÷H2O2起始物质的量)×100%.
解答 解:A.发生反应:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,2min时间内,生成氧气$\frac{0.0096L}{22.4L/mol}$≈4.29×10-4mol,△c(H2O2)=4.29×10-4mol×2÷0.01L=0.0858mol/L,故2min时浓度过氧化氢的浓度为0.4mol/L-0.0858mol/L≈0.314 mol/L,故A正确;
B.0~4 min,生成氧气$\frac{0.0168L}{22.4L/mol}$=7.5×10-4mol,△c(H2O2)=7.5×10-4mol×2÷0.01L=0.015mol/L,则v(H2O2)=$\frac{0.015mol/L}{4min}$=3.75×10-2 mol/(L•min),故B正确;
C.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,故C错误;
D.0~6min时间内,生成氧气为$\frac{0.0224L}{22.4L/mol}$=0.001mol,则△n(H2O2)=0.002mol,故H2O2分解率=$\frac{0.002mol}{0.01L×0.4mol/L}$×100%=50%,故D正确,
故选:C.
点评 本题考查化学平衡有关计算、化学反应速率计算、化学反应速率影响因素等,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上以硫或二硫化亚铁(FeS2)为原料制备硫酸 | |
| B. | 电解NaCl溶液制备金属钠同时得到Cl2 | |
| C. | 用H2或CO还原Al2O3制备金属铝 | |
| D. | 用裂化的方法生产大量乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M电极 | N电极 | 电解质溶液 | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)(mol) | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
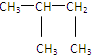 ⑩
⑩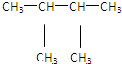 ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫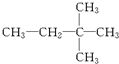
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L | B. | 6.27 L | C. | 5.6 L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②和③ | C. | ③和④ | D. | ②和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com