
【题目】已知0.5L的NaCl溶液中含有0.5molNa+。下列关于该溶液的说法不正确的是( )
A. 该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5gNaCl
C. 配制1000mL该溶液需用58.5gNaCl
D. 量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含___________个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_______g;
(2)2mol CO2中含______ mol碳原子__________个氧原子(以NA为阿伏加德罗常数的值),________个质子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L,质量是______________g。
(3)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g,
①CO的质量为________
②混合气体的平均摩尔质量为________
③CO2的体积为________
④混合气体的密度为_____(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Fe(SO4)2·12H2O被称为“铁铵矾”,广泛用于城镇生活用水、工业循环水的净化处理。某同学称取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
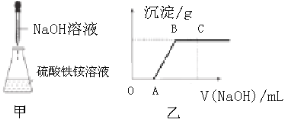
请回答下列问题。
(1)溶解NH4Fe(SO4)2·12H2O固体所用的玻璃仪器有___(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______。
(3)AB段反应的离子方程式为______。
(4)BC段反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为_______。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A 的相对分子质量比B大14。
①该反应的化学反应方程式为_____________________。
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为_________。

(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。______
(2)该反应中Cl2是___(填氧化剂、还原剂、氧化产物或还原产物),HCl被氧化部分和未被氧化部分之比为___。

已知:氯气有毒,溶入水显酸性(反应方程式为Cl2+H2O=HCl +HClO)。氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大。
(3)装置C的作用是___,装置D的作用是____,为了避免尾气排入空气污染环境,装置F中的试剂是___。
(4)氯气与水反应过程中,氧化剂和还原剂之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com