
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为_______。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A 的相对分子质量比B大14。
①该反应的化学反应方程式为_____________________。
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为_________。

(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为________________________________。
【答案】(1)焊接钢轨;
(2)4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)2Na2O2+2H2O=4NaOH+O2↑;
(4)①CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②C2H5OH﹣4e﹣+H2O=CH3COOH+4H+;
(5)2ClO2+5Mn2++6H2O=5MnO2↓+2Cl﹣+12H+.
【解析】
(1)高温条件下,铝和氧化铁发生铝热反应而放出大量热而使铁熔融,所以能用于焊接钢轨,故答案为:焊接钢轨;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,则A是氨气,氨气在催化剂、加热条件下能和氧气反应生成NO和水,反应方程式为4NH3+5O2![]() 4NO+6H2O,(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
4NO+6H2O,(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A的相对分子质量比B大14,A能和B反应生成C和D,A为乙酸、B为乙醇;
①在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应,反应方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②该燃料电池中,负极上乙醇失电子发生氧化反应,该电解质溶液呈酸性,所以生成氢离子和二氧化碳,电极反应式为C2H5OH﹣4e﹣+H2O=CH3COOH+4H+,故答案为:C2H5OH﹣4e﹣+H2O=CH3COOH+4H+;
(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl﹣,根据反应物和生成物及转移电子守恒书写离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl﹣+12H+.


科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.5L的NaCl溶液中含有0.5molNa+。下列关于该溶液的说法不正确的是( )
A. 该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5gNaCl
C. 配制1000mL该溶液需用58.5gNaCl
D. 量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的CO和SO2分别装入同温同体积的容器,所含氧原子之比___,压强之比___。
(2)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是___,混合气体的平均摩尔质量是___。
(3)将标准状况下aL的HCl(g)溶于1000g水,得到的盐酸的密度为bg/cm3,则该盐酸的物质的量浓度为___mol·L-1。
(4)1.204╳1023个NH4+的物质的量为__mol,质量为____g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作正确的是( )
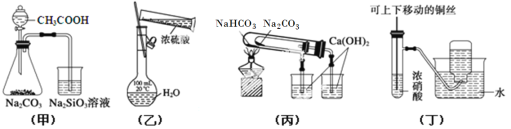
A. 用甲图装置验证CH3COOH、H2CO3和H2SiO3的酸性强弱
B. 用乙图装置配制一定浓度的稀硫酸
C. 用丙图装置验证NaHCO3和Na2CO3的热稳定性
D. 用丁图装置制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com