
【题目】常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列关于混合溶液的说法(或关系式)正确的是
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.c(Na+)>c(X-)>c(HX)>c(OH-)>c(H+)
【答案】A
【解析】
取0.2molL-1HX溶液与0.2molL-1NaOH溶液等体积混合,恰好生成NaX,测得混合溶液的pH=8,说明溶液呈碱性,NaX为强碱弱酸盐,结合盐类水解原理以及物料守恒解答该题。
A. 该盐溶液中存在电荷守恒,即c(Na+)+c(H+)=c(X)+c(OH),移项得![]() 故A正确;
故A正确;
B. 等物质的量的该酸和氢氧化钠恰好反应生成盐,盐溶液中存在物料守恒,即![]() ,故B错误;
,故B错误;
C. 该盐溶液中存在电荷守恒,即c(Na+)+c(H+)=c(X)+c(OH)①,存在物料守恒,即c(Na+)=c(X)+c(HX)②,将②带入①得c(HX)+c(H+)=c(OH),所以c(OH)c(HX)=c(H+)=1×108molL1,故C错误;
D.由C可知c(OH)> c(HX),故D错误;
故答案选:A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:![]()
B. 2-甲基-2-戊烯的键线式:![]()
C. ![]() 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,在催化剂存在时反应过程中的能量变化如图所示。下列叙述正确的是
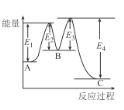
A.△H=E2-E1+E3-E4
B.加入催化剂后反应经过两步完成,其中第一步反应决定总反应速率
C.加入催化剂,△H、反应速率均发生改变
D.向密闭容器中充入3 mol H2和1molN2,发生上述反应,达到平衡时,反应放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将石灰石和硫煤混合使用,称之为“固硫”,其反应原理为:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
请回答下列问题:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃时,向某恒容密闭容器中通入一定量的CO2和足量CaO发生反应:CaO(s)+CO2(g)![]() CaCO3(s),CO2的浓度随时间变化如图所示:
CaCO3(s),CO2的浓度随时间变化如图所示:
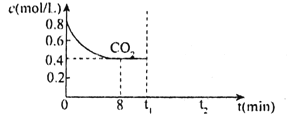
①0~8min,v(CO2)=___。
②t1min时,若保持其他条件不变,压缩容器体积至原来的![]() ,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
(3)T2℃时,向某密闭容器中通入2molSO2和1molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若该容器为恒压密闭容器,下列选项可判断反应已达平衡状态的是___。
A.混合气体的密度不再改变
B混合气体的压强不再改变
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3
D.混合气体的平均相对分子质量不再改变
②若该容器为2L的恒容密闭容器,达平衡时SO3的体积分数为40%,则O2的转化率为___,T2℃时该反应的平衡常数K=___。
③反应达到②中的平衡状态后,保持反应温度和O2的浓度不变,增大容器体积,则平衡将___(填“正向”、“逆向”或“不“)移动,原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中加入浓度均为0.2 mol·L1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.单位时间内消耗1 mol CO同时生成1 mol CO2
B.混合气体的密度不再变化
C.CO、H2O、CO2和H2 的浓度不再变化
D.混合气体的平均摩尔质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
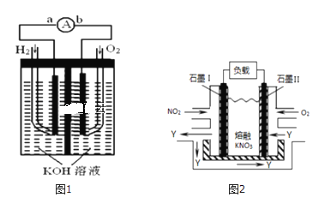
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斑蝥黄是一种有机颜料,其结构如图所示,下列说法正确的是

A.斑蝥黄的分子式为 C40H50O2
B.斑蝥黄的一氯代物可能存在 13 种结构(不考虑立体异构)
C.斑蝥黄能发生加成反应和酯化反应
D.斑蝥黄易溶于水和有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com