
【题目】下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
【答案】A
【解析】
A. 氯化铵为强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量,由于二者物质的量浓度相等,因此氨水体积要大于盐酸,A错误;
B. 溶液导电性与离子浓度成正比,一水合氨是弱电解质,氯化铵是强电解质,向0.1 mol/L氨水中加入等浓度等体积的盐酸,二者恰好反应产生NH4Cl,混合后溶液中离子浓度增大,因此溶液导电性增强,B正确;
C. 室温下pH相等的醋酸和盐酸溶液中c(H+)相等,温度不变离子积常数不变,溶液中c(OH-)=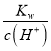 也相等,C正确;
也相等,C正确;
D. 室温下pH=1的醋酸溶液中c(H+)=0.1 mol/L,pH=13的NaOH溶液中c(OH-)=0.1 mol/L,各溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-)、c(OH-)=c(Na+)+c(H+),根据室温下水的离子积等于常数,所以酸中c(OH-)等于碱中c(H+),所以存在c(CH3COO-)=c(Na+),D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 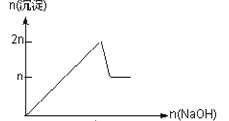
B. 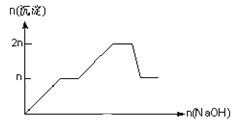
C. 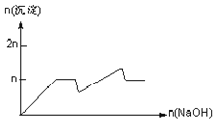
D. 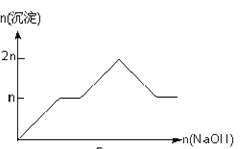
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知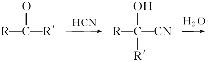
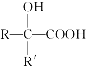 ,产物分子比原化合物分子多一个碳原子,增长了碳链。分析如图变化,并回答有关问题:
,产物分子比原化合物分子多一个碳原子,增长了碳链。分析如图变化,并回答有关问题:
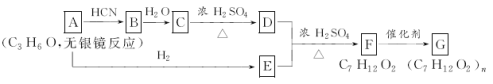
(1)写出有关物质的结构简式:A:____________;C:________________。
(2)指出反应类型:C→D:___________;F→G:________________。
(3)写出下列反应的化学方程式:D+E→F:_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾醉驾危害社会安全,早期测定是否饮酒的方法是重铬酸钾法:溶液由橙红色变为绿色(Cr3+)则表明已经饮酒。写出重铬酸钾法检验饮酒的离子方程式:___________________________。
(2)用铬铁矿(FeOCr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺:
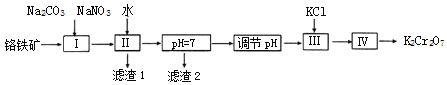
已知:i. 2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O;
Cr2O72﹣+H2O;
ii.常温,Ksp[Al(OH)3]=1.3×10﹣33;
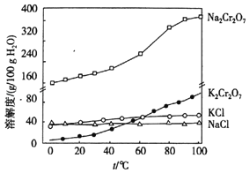
iii.有关物质的溶解度曲线如图:
①上述工艺流程图中的操作I的主要反应为:2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
②滤渣2的成分是_____(写化学式),常温,滤液中,c(Al3+)=_____molL﹣1
③工艺流程图中,操作“调节pH”的作用是_________________________________。
④操作Ⅲ,加入KCl的目的是________________________________________;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
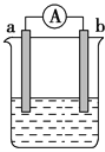
(1)若电极a为Zn,电极b为石墨,当电解质溶液为稀硫酸时,该电池的负极的电极反应式为:___;当反应中收集到标准状况下672 mL气体时,电池中所转移的电子数目为____。
(2)现设计一燃料电池,以电极a为正极,电极b为负极,甲醇(CH4O)为燃料,采用氢氧化钠溶液为电解质溶液,则氧气应通入____极(填“a”或“b”),另一电极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com