

| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
分析 废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO,废旧黄铜加入过量稀硫酸过滤得到不溶物E为Cu,滤液A为硫酸亚铁、硫酸锌,滤液A中加入过氧化氢氧化剂氧化亚铁离子为铁离子,加入氧化锌调节溶液PH3.0--5.9铁离子全部沉淀,锌离子不沉淀,过滤得到滤液中加入碱溶液沉淀锌离子生成氢氧化锌,灼烧得到氧化锌;或滤液A中加入过量试剂Y为氢氧化钠溶液,亚铁离子全部沉淀,过滤后的滤液中为Na2ZnO2,加入酸反应生成氢氧化锌沉淀,灼烧得到氧化锌;不溶物E中通入氧气同时加入稀硫酸溶液反应生成硫酸铜溶液,蒸发浓缩,冷却结晶得到硫酸铜晶体;
(1)调节溶液pH,降低溶液酸度,可以使铁离子全部沉淀,从而除去,同时不能沉淀锌离子,分析图表数据确定a的取值;
(2)酸性条件下Cu与氧气发生氧化还原反应生成硫酸铜和水;
(3)酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子;
(4)依据从溶液中得到固体需要蒸发浓缩、冷却结晶以及过滤等回答;
(5)此过程需要调节pH值大于11,故可以加入强碱;pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解.
解答 解:由流程可知,废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO,废旧黄铜加入过量稀硫酸过滤得到不溶物E为Cu,滤液A为硫酸亚铁、硫酸锌,滤液A中加入过氧化氢氧化剂氧化亚铁离子为铁离子,加入氧化锌调节溶液PH3.0--5.9铁离子全部沉淀,锌离子不沉淀,过滤得到滤液中加入碱溶液沉淀锌离子生成氢氧化锌,灼烧得到氧化锌;或滤液A中加入过量试剂Y为氢氧化钠溶液,亚铁离子全部沉淀,过滤后的滤液中为Na2ZnO2,加入酸反应生成氢氧化锌沉淀,灼烧得到氧化锌;不溶物E中通入氧气同时加入稀硫酸溶液反应生成硫酸铜溶液,蒸发浓缩,冷却结晶得到硫酸铜晶体;
(1)氧化锌为碱性氧化物,能与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去,故答案为:降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去,铁离子完全沉淀的PH=3.0,锌开始沉淀的PH=5.9,所以满足程度铁离子,锌离子不沉淀的PH取值范围为:3.0≤a<5.9;
故答案为:使溶液中的Fe3+完全沉淀,Zn2+不被沉淀;3.0≤a<5.9;
(2)因为氧气在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(3)滤液A中主要是硫酸亚铁,酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子,离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)由溶液D制胆矾晶体是从溶液中得到固体,实验操作需要蒸发浓缩、冷却结晶以及过滤等操作,故答案为:蒸发浓缩、冷却结晶、过滤;
(5)Zn及化合物的性质与Al及化合物的性质相似,氢氧化锌具有两性,pH>11时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,此过程需要调节pH值大于11,故可以加入强碱NaOH溶液,然后加入酸先生成氢氧化锌沉淀,继续加入酸,沉淀溶解,
故答案为:B;先产生白色沉淀后溶解.
点评 本题考查制备实验方案的设计,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol/L | |
| B. | Na2S2O3溶液PH=8的原因用离子方程式表示为S2O32-+2H2O═H2S2O3+2OH- | |
| C. | 生成的沉淀BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 、
、 (写2种).
(写2种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
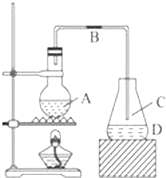 某化学课外小组用如图装置制取溴苯,请按要求完成下列小题:
某化学课外小组用如图装置制取溴苯,请按要求完成下列小题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
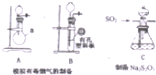 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.99 | 23.00 | 20.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
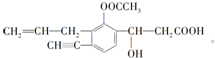
 +NaHCO3→
+NaHCO3→ +CO2↑+H2O.
+CO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com