
分析 (1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
③根据硫酸铵晶体中存在的化学键判断;
(4)B原子含有3个σ 键一个配位键,B原子提供空轨道的原子、N原子提供孤电子对.
解答 解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,故答案为:2s22p3;
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的价层电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,
故答案为:三角锥型;sp3;
②1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,故答案为:3;
③3N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,
故答案为:d;
(4)BF3•NH3中B原子其价层电子数是4,采取sp3杂化,B原子含有3个σ 键一个配位键,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,B、N原子之间形成配位键,
故答案为:N;B.
点评 本题考查了电子排布式、第一电离能的比较、原子的杂化方式的判断、化学键、等电子体等知识点,题目难度中等,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入饱和FeCl3溶液得到的红褐色液体 | |
| D. | 向NaOH溶液中通入CO2得到的无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )甲酯并计算其产率.实验步骤如下:
)甲酯并计算其产率.实验步骤如下: 水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
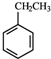 (g)+CO2(g)?
(g)+CO2(g)?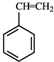 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
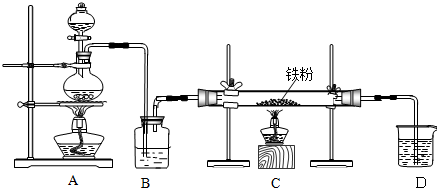
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一个化学变化都伴随着能量的变化 | |
| D. | 新制的氯水中存在着三种分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com