
 )甲酯并计算其产率.实验步骤如下:
)甲酯并计算其产率.实验步骤如下: 水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |

分析 Ⅰ.在浓硫酸作用下水杨酸和甲醇发生酯化反应生成水杨酸甲酯,发生酯化反应时生成水,水和甲苯能形成共沸物,从而易将水蒸出,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率;加热时加入沸石能防止溶液暴沸,从而减小安全事故的发生;发生酯化反应温度低于100℃,最好使用水浴加热,易控制温度;
Ⅱ.反应后的溶液要经过多次洗涤,在洗涤操作中,第一次水洗的主要目的是除去大部分催化剂硫酸,5%NaHCO3溶液既可以除去未洗净的硫酸,也可以降低酯的溶解度,但第二步洗涤后生成的酯中混有NaHCO3,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;用硫酸镁吸收水分;
Ⅲ.互溶的液体应该采用蒸馏方法分离,所以将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯.
(1)仪器A的名称是冷凝管;水浴加热适用于降低温度的加热;
(2)沸石有防暴沸作用;
(3)甲苯和水能形成共沸物,使合成水杨酸甲酯反应的化学平衡向右移动,从而提高反应的产率;
(4)互溶的液体采用蒸馏方法分离;
(5)水能溶解可溶酸、碱、盐;
(6)蒸馏时,温度计测量馏分温度;
(7)先根据水杨酸和甲醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成水杨酸甲酯的物质的量,最后根据实际上制取的水杨酸甲酯计算出产率.
解答 解:Ⅰ.在浓硫酸作用下水杨酸和甲醇发生酯化反应生成水杨酸甲酯,发生酯化反应时生成水,水和甲苯能形成共沸物,从而易将水蒸出,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率;加热时加入沸石能防止溶液暴沸,从而减小安全事故的发生;发生酯化反应温度低于100℃,最好使用水浴加热,易控制温度;
Ⅱ.反应后的溶液要经过多次洗涤,在洗涤操作中,第一次水洗的主要目的是除去大部分催化剂硫酸,5%NaHCO3溶液既可以除去未洗净的硫酸,也可以降低酯的溶解度,但第二步洗涤后生成的酯中混有NaHCO3,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;用硫酸镁吸收水分;
Ⅲ.互溶的液体应该采用蒸馏方法分离,所以将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯.
(1)仪器A的名称是冷凝管;水浴加热适用于降低温度的加热,制取水杨酸甲酯所需温度低于100℃,最好使用水浴加热,易控制温度,故答案为:冷凝管;水浴加热;
(2)沸石有防暴沸作用,防止安全事故的发生,故答案为:防暴沸;
(3)水和甲苯能形成共沸物,从而易将水蒸出,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率,故答案为:反应产生的水;
(4)互溶的液体采用蒸馏方法分离,甲醇和水杨酸甲酯互溶,应该采用蒸馏方法分离,故答案为:蒸馏;
(5)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次水洗的主要目的是除去大部分催化剂硫酸,5%NaHCO3溶液既可以除去未洗净的硫酸,也可以降低酯的溶解度,但第二步洗涤后生成的酯中混有NaHCO3,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,故答案为:洗掉大部分硫酸;洗掉碳酸氢钠;
(6)蒸馏时,温度计测量馏分温度,只有b中温度计测量的是馏分温度,故选b;
(7)水杨酸和甲醇的物质的量分别为:0.05mol、0.75mol,由于水杨酸和甲醇是按照1:1进行反应,所以甲醇过量,生成水杨酸甲酯的量要按照水杨酸的物质的量计算,即理论上生成0.05mol水杨酸甲酯;实际上生成的水杨酸甲酯的质量为5.3g,物质的量为:$\frac{5.3g}{152g/mol}$=0.0349mol,所以实验中水杨酸甲酯的产率为$\frac{0.0349mol}{0.05mol}$×100%=70%,故答案为:70%.
点评 本题考查制备实验方案设计,为高频考点,涉及常见仪器的构造与安装、混合物的分离、提纯、物质的制取、物质产率的计算等知识,明确实验基本操作及各物质性质是解本题关键,难点是(5)中各洗涤剂的作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3.01×1023 | B. | 5.32×1026 | C. | 6.02×1026 | D. | 1.2×1026 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
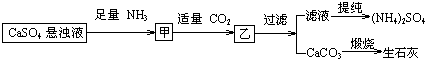
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com