
下列解释事实的方程式表达不正确的是
A.碳酸氢钠可作食品膨松剂:2NaHCO3 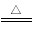 Na2CO3+ CO2↑+H2O
Na2CO3+ CO2↑+H2O
B.铝制容器不能盛装碱液:2Al +2OH-+2H2O = 2AlO2-+ 3H2↑
C.氯气可用于消毒:Cl2+H2O = 2H++ Cl-+ClO-
D.过氧化钠可用于呼吸面具:2Na2O2 + 2CO2 = 2 Na2CO3 + O2
C
【解析】
试题分析:A.碳酸氢钠不稳定,受热发生分解反应:2NaHCO3  Na2CO3+ CO2↑+H2O,产生CO2,使食物膨松。故可作食品膨松剂。正确。B.金属Al能与强碱发生反应:2Al +2OH-+2H2O=2AlO2-+ 3H2↑,所以铝制容器不能盛装碱液。正确。C.氯气可用于消毒:Cl2+H2O
Na2CO3+ CO2↑+H2O,产生CO2,使食物膨松。故可作食品膨松剂。正确。B.金属Al能与强碱发生反应:2Al +2OH-+2H2O=2AlO2-+ 3H2↑,所以铝制容器不能盛装碱液。正确。C.氯气可用于消毒:Cl2+H2O H++Cl-+HClO,HClO是弱酸,不能写成离子形式。错误。D.过氧化钠能与人呼吸产生的H2O蒸汽及CO2发生反应产生氧气:2Na2O2+2H2O=4NaOH+ O2↑;2Na2O2 + 2CO2=2 Na2CO3 + O2因此可用于呼吸面具。正确。
H++Cl-+HClO,HClO是弱酸,不能写成离子形式。错误。D.过氧化钠能与人呼吸产生的H2O蒸汽及CO2发生反应产生氧气:2Na2O2+2H2O=4NaOH+ O2↑;2Na2O2 + 2CO2=2 Na2CO3 + O2因此可用于呼吸面具。正确。
考点:考查化学事实的化学方程式及离子方程式的正确书写的知识。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 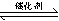 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的最佳途径是使用高效催化剂
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的常用方法是升高温度
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g) 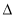 H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.050 | 0.025 | 0.025 |
30 | 0.050 | 0.025 | 0.025 |
40 | 0.036 | 0.032 | 0.010 |
50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
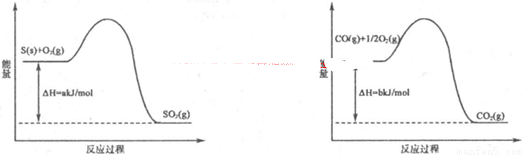
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
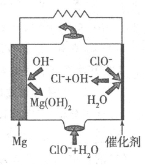
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
元素 | 有 关 信 息 |
A | 元素主要化合价为-2,原子半径为0.074 nm |
B | 所在主族序数与所在周期序数之差为4 |
C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为 NA。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
W | X |
|
| Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
已知A(g)+B(g) 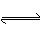 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)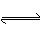 A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
W、X、Y、Z、R属于短周期元素。已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2∶1。下列叙述中,错误的是
A.分别由Y、Z组成的单质一定都为原子晶体
B.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2
C.Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y
D.X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物低
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列化学用语中,表示正确的是
A.2s的电子云模型是: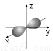
B.肽键的结构式为: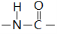
C.H2S分子的球棍模型为:
D.最外层电子排布式为ns2np3对应的轨道表示式为: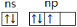
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2 2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
A.①②⑥ B.②③④⑤ C.③ D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com