
�о���Աͨ���Ա�������PM2��5�Ļ�ѧ����о����֣�����β����ȼú��Ⱦ�ֱ� ռ4����l8��
I����1�����ھ�������β���ķ�ӦΪ��2NO(g)+2CO(g) 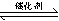 2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�
2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�
A��װ��β������װ�õ������ų��������в��ٺ���NO��CO
B�����β������Ч�ʵ����;����ʹ�ø�Ч����
C������ѹǿ������ƽ�����ƣ���ʵ�ʲ����п�ͨ����ѹ�ķ�ʽ����侻��Ч��
D�����β������Ч�ʵij��÷����������¶�
��2���������û���̿��ԭ���������������ӦΪ��C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g) 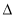 H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/mol��L-1 ʱ��/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.050 | 0.025 | 0.025 |
30 | 0.050 | 0.025 | 0.025 |
40 | 0.036 | 0.032 | 0.010 |
50 | 0.036 | 0.032 | 0.010 |
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K= (������λС��)��
��ǰ10min����v(NO)��ʾ�Ļ�ѧ��Ӧ����Ϊ ��30min�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������ ��
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��l����÷�Ӧ��a 0(�>������=����<��)��
��CO���������滷����Ӱ��ܴ�CO�����������ڵ��������ȵ����⡣
��1����ҵ�ϳ���SO2��ȥCO��������ΪS��CO2����֪��ط�Ӧ���̵������仯��ͼ��ʾ
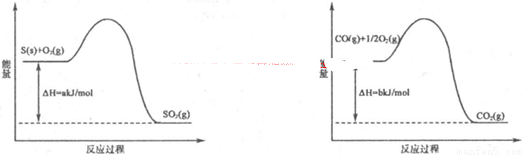
����SO2��ȥCO���Ȼ�ѧ����ʽΪ ��
��2������ʱ��Ҳ������CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3���˷�Ӧ�Ļ�ѧ����ʽ�� ��
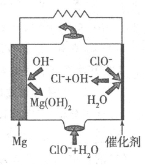
����Mg���Ƴɡ�þһ�������Ρ���أ���װ��ʾ��ͼ��ͼ����þ�缫�����ĵ缫��ӦʽΪ ���õ���ܷ�Ӧ�����ӷ���ʽΪ ��
I��1��B ��2���� 0.25 �� 0.0042mol???L-1?min-1������CO2Ũ�� �� <
II��1��SO2(g)+2CO(g)=S(s)+2CO2(g) ?H=(2b��a)kJ?mol?1
��2����2MgSO4+CO  2MgO+SO2+CO2+SO3
2MgO+SO2+CO2+SO3
�� Mg��2e?+2OH?=Mg(OH)2��Mg��2e?=Mg2+ Mg+ClO?+H2O=Cl?+Mg(OH)2
��������
���������I��1���÷�Ӧ��ƽ�ⳣ���Ѿ��ܴ��ˣ��������β������Ч�ʹؼ��Ǽӿ췴Ӧ���ʡ�A����Ϊ�÷�ӦΪ���淴Ӧ������װ��β������װ�õ������ų�����������Ȼ����NO��CO������B��ʹ�ø�Ч�������Լӿ췴Ӧ���ʣ��������β������Ч�ʵ����;����ʹ�ø�Ч��������ȷ��C������ѹǿ������β�����ŷź�������������D�������¶ȣ�����β�����ŷź�������������
��2���ٷ�Ӧ���е�20minʱ�ﵽƽ�⣬��������ʽ���м���:
C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g)
��ʼŨ�ȣ�mol?L?1�� 0.100 0 0
ת��Ũ�ȣ�mol?L?1�� 0.050 0.025 0.025
ƽ��Ũ�ȣ�mol?L?1�� 0.050 0.025 0.025
�÷�Ӧ��ƽ�ⳣ��K= 0.025��0.025��0.0502=0.25��
�� v(NO)=(0.1000mol?L?1��0.058mol?L?1)��10min =0.0042mol???L-1?min-1��30min�ı�ijһ��������Ӧ���´ﵽƽ���Ӧ��NO��Ũ�ȼ�С��������N2Ũ������CO2��Ũ�ȼ�С�����Ըı�����������ǣ�����CO2Ũ�ȡ�
�� T1�� 30minʱ��NO��N2��CO2��Ũ��֮��Ϊ2:1:1�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��l��˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ����÷�ӦΪ���ȷ�Ӧ��a < 0
II��1�����������仯ͼ�ɵ��Ȼ�ѧ����ʽ��S(s)+O2(g)=SO2(g) ?H1=a kJ?mol?1 CO(g)+1/2O2(g)=CO2(g) ?H2=b kj/mol��д����SO2��ȥCO�Ļ�ѧ����ʽ��ע��״̬�����ݸ�˹�������ʱ䣬?H=��?H1+ 2?H2 = =(2b��a)kJ?mol?1���ɵ��Ȼ�ѧ����ʽ��
��2����CO��ԭMgSO4���Ʊ��ߴ�MgO�����ɵ����ʵ�����SO2��SO3������Ԫ���غ�ͬʱ����CO2����ƽ�ɵû�ѧ����ʽ��2MgSO4+CO  2MgO+SO2+CO2+SO3��
2MgO+SO2+CO2+SO3��
�� MgΪ���ý�����Ϊ����ʧȥ���ӣ��缫����ʽΪ��Mg��2e?+2OH?=Mg(OH)2��Mg��2e?=Mg2+���ܷ�ӦΪClO?�ڼ��������°�Mg����ΪMg(OH)2�����ӷ���ʽΪ��Mg+ClO?+H2O=Cl?+Mg(OH)2
���㣺���⿼�黯ѧ��Ӧ���ʡ���ѧƽ�⡢��ѧ��Ӧ������ת����ԭ���ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и���4��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��ѧ��ѧ�����л���A��C6H6O���ܺϳ����������ռ�BAD��ijҩ���м���F���ϳ�·��Ϊ��
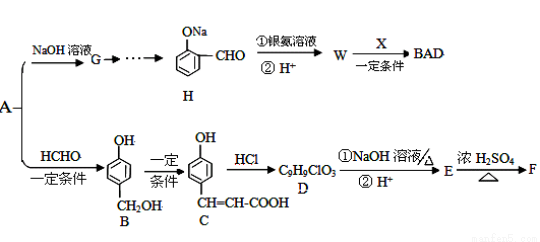
��֪��BAD�Ľṹ��ʽΪ��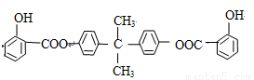
F�Ľṹ��ʽΪ��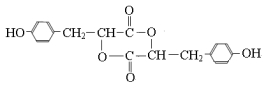
C�к��������ŵ����� ��W�Ľṹ��ʽ ��
��2����Ӧ���� A��B ��
��3��1mol C��ַ�Ӧ�������� mol Br2 ��C���� NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
��4��C��D�Ĺ����п�������һ�ֲ���D1��D1�Ľṹ��ʽ ��
��5��E�Ľṹ��ʽΪ ����Ӧ���� E��F ��
��6��W��ͬ���칹���ж��֣�д��һ�ַ�������Ҫ���W��ͬ���칹��Ľṹ��ʽ��
�� ��FeCl3��Һ����ɫ�� �� �ܷ���������Ӧ���� �����ϵ�һ�ȴ���ֻ�����֡� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡʮУ����������ѧ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���д�ʩ����������
A���ñ���Na2CO3��Һ��ȥ���������е�����
B�������Ը��������Һ���𱽺ͼױ�
C��ʵ������ϡ������MnO2��ϼ����Ʊ�Cl2
D����CCl4��ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�ĵ��и���������ͳ�������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
ƽ���ǻ�ѧ��Ӧԭ���е���Ҫ���ݡ���Ҫ��ش��������⣺
��1����֪��2SO2(g)+O2(g) 2SO3(g) ��H1 ƽ�ⳣ��ΪK1
2SO3(g) ��H1 ƽ�ⳣ��ΪK1
2NO(g)+O2(g) 2NO2(g) ��H2 ƽ�ⳣ��ΪK2
2NO2(g) ��H2 ƽ�ⳣ��ΪK2
��ӦNO2(g)+SO2(g) SO3(g)+NO(g)�Ħ�H=______ (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)��
SO3(g)+NO(g)�Ħ�H=______ (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)��
��2����֪A(g)+B(g)  C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��
C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��

��ʵ�����ܸı��������_______________��
��T1��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ_____(�÷����� ʾ)���ﵽƽ��ʱ��A�ķ�Ӧ����Ϊ____��
��3����֪HCN��Һ�ĵ���ƽ�ⳣ��Ka=10��5 mol?L��1��cƽ��(HCN)��c��ʼ(HCN)��ˮ�ĵ���ɲ��ƣ�����¶���0.1 mol?L��1��HCN��Һ��pH=_________��
��4������0.1mol?L��1 Na2CO3��Һ������Һ������Ũ���ɴ�С��˳����______�������Һ�м�ˮϡ�͵Ĺ����У�c(H2CO3)��____(��������䡱��С���� ��ͬ) ��c(H2CO3)/ c(CO32��)��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�ĵ��и���������ͳ�������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����̫���ܵ�ذ��ڹ���ʱ�����Խ���ѧ��ת��Ϊ����
B�����ۺ���ά�ؾ���ˮ�����������ǣ��ʾ�����Ϊ�����Ӫ������
C��232Th ת����233U�ǻ�ѧ�仯��233U��235U�Ļ�ѧ���ʼ�����ͬ
D���������Ϸ�����Ҫ�����Ǹ߷��Ӳ��ϣ�������ʢ�ź��ͽ϶��ʳƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и���4��ģ�⿼�ԣ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���У���ȷ����
A����������������ͭ��Һ�еķ�Ӧ���ԱȽ�Cu��Fe2+�Ļ�ԭ��
B��������ͭ��һ������Ũ���ᷴӦֻ����һ������
C�����Ĺ̶�ֻ���ڸ��¡���ѹ�������������²���ʵ��
D������Ϊ������ͭƬΪ����������ͭΪ���Һ����ʵ������Ʒ��ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������и����꼶4�¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ݻ���Ϊ1L�ĺ��������У��ֱ����2molA��2molB��1molA��1molB����ͬ�����£��������з�ӦA��g��+B��g�� xC��g�� ��H��0�������������c��A����ʱ��t�ı仯��ͼ��ʾ������˵����ȷ����
xC��g�� ��H��0�������������c��A����ʱ��t�ı仯��ͼ��ʾ������˵����ȷ����
A��x����2
B����ƽ�����������г��뺤����ʹc(A) ����
C�����������������£���ʹ�������и����ʵ����������������ڵ���ͬ
D��������������ٳ���2 molA��2 molB����ƽ��ʱ��������0��78 mol��L-1��c��A����1��56 mol��L-1
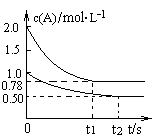
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱��˳���������ڶ���ͳ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
���ù�ҵ��ͭ���¯��(��Fe2O3��FeO��SiO2��Al2O3)���Ʊ����߷����������ۺ��Ȼ����;�ˮ����������(Na2FeO4)���乤����������(���ֲ�����������)��
����ϡ�����ȡ¯�������ˣ�
������Һ�м������NaClO��Һ����pHԼΪ3�����ˣ�
����Һ���м�ѹ�����Ȳ���,˦�ɺ�����ۺ�¯�н��и��¾ۺϣ������õ��ۺ��Ȼ�����
���������еõ�����ϴ�ӡ�����,����NaClO��NaOH��Ӧ�����ɸ������ơ�
��1��ϡ�����ܽ�Fe2O3�����ӷ���ʽ�� ��
��2����֤¯���к���FeO��Ҫ�Ļ�ѧ�Լ�Ϊ ��
��3����֪�������������������pH
���� | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
��ʼ����ʱ | 1��5 | 3��4 | 6��3 |
��ȫ����ʱ | 2��8 | 4��7 | 8��3 |
�ٲ�����м������NaClO����Ӧ�����ӷ���ʽ�� ��
�ڸ��ݱ������ݽ��Ͳ�����У���pHԼΪ3��Ŀ���� ��
��4���ù�ҵ���̴���ȱ�㣬�ڲ����������������������˷�Ӧ����ʽ�� ��
��5����������ڼ�ѹ������˦�ɲ���֮�䣬������еIJ����� ��
��6���ڲ�����У����÷�Ӧ����166 g Na2FeO4ת��3 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱���з�̨��������ѧ��ͳһ��ϰ��һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���н�����ʵ�ķ���ʽ���ﲻ��ȷ����
A��̼�����ƿ���ʳƷ���ɼ���2NaHCO3 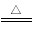 Na2CO3+ CO2��+H2O
Na2CO3+ CO2��+H2O
B��������������ʢװ��Һ��2Al +2OH��+2H2O = 2AlO2��+ 3H2��
C������������������Cl2+H2O = 2H��+ Cl��+ClO��
D���������ƿ����ں�����ߣ�2Na2O2 + 2CO2 = 2 Na2CO3 + O2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com