
ЁОЬтФПЁП(1)250ЁцЪБЃЌвдФјКЯН№ЮЊДпЛЏМСЃЌЯђГѕЪМЬхЛ§ЮЊ 8L ЕФУмБеШнЦїжаЭЈШы 5molCO2ЁЂ3molCH4ЃЌдкКубЙЬѕМўЯТЗЂЩњЗДгІЃКCO2(g) +CH4(g)2CO(g) + 2H2(g)ЁЃЦНКтЬхЯЕжаМзЭщЕФЮяжЪЕФСПБфЛЏМћБэЁЃ
ЗДгІЪБМф(s) | 2 | 4 | 6 | 8 |
CH4ЮяжЪЕФСП(mol) | 2.7 | 2.4 | 2.0 | 2.0 |
ДЫЮТЖШЯТЃЌИУЗДгІЕФЦНКтГЃЪ§K =_____ЁЃ
(2)ЖўМзУбДпЛЏжиећжЦЧтЕФЗДгІЙ§ГЬЃЌжївЊгавдЯТМИИіЗДгІ(Ъ§ОнЮЊ 25ЁцЁЂ1.01ЁС105Pa ВтЖЈ)
Ђй CH3OCH3(g) + H2O(l)2CH3OH(l) ЁїHЃНЃЋ24.52kJ/mol
Ђк CH3OH(l) + H2O(l)CO2(g) + 3H2(g) ЁїHЃНЃЋ49.01kJ/mol
Ђл CO(g) + H2O(l)CO2(g) + H2(g) ЁїHЃНЃ41.17kJ/mol
Ђм CH3OH(l)CO (g) + 2H2(g) ЁїHЃНЃЋ90. 18kJ/mol
дђ CH3OCH3(g) +3H2O(l)2CO2(g) + 6H2(g) ЁїH =_____kJ/mol
(3)ЩЯЪі(2)жаЖўМзУбДпЛЏжиећжЦЧтЕФЙ§ГЬжаВтЕУВЛЭЌЮТЖШЯТИїзщЗжЬхЛ§ЗжЪ§МАЖўМзУбЕФзЊЛЏТЪЙиЯЕШчЭМЫљЪОЃК
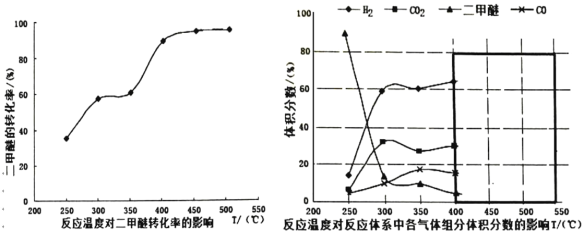
ЂйФуШЯЮЊЗДгІПижЦЕФзюМбЮТЖШгІЮЊ_____________ЃЌРэгЩЪЧ__________ЁЃ
A.300ЁЋ350Ёц B.350ЁЋ400Ёц C.400ЁЋ450Ёц D.450ЁЋ500Ёц
ЂкдквЛИіОјШШКуШнЕФУмБеШнЦїжаЃЌЗХШывЛЖЈСПЕФМзДМШчЂмЪННЈСЂЦНКтЃЌвдЯТПЩвдзїЮЊИУЗДгІДяЕНЦНКтзДЬЌЕФХаЖЯвРОнЕФЪЧ____________ЁЃ
A.ЬхЯЕЕФЮТЖШВЛдйИФБф B.ЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБЃГжВЛБф
C.CO ЕФЬхЛ§ЗжЪ§ВЛБф D.ЦјЬхЕФУмЖШБЃГжВЛБф
Ђл дкЮТЖШДяЕН 400ЁцвдКѓЃЌЖўМзУбгы CO2вдМИКѕЯрЭЌЕФБфЛЏЧїЪЦУїЯдНЕЕЭЃЌЖј CO КЭ H2ЗЂЬхЛ§ЗжЪ§вВвдМИКѕЯрЭЌЕФБфЛЏЧїЪЦЩ§ИпЁЃдђДЫЪБЗЂЩњЕФЗДгІЮЊ_______________ЪддкЭМжаКкЩЋЗНПђФкЛГі 400ЁцвдКѓЕФ CH3OCH3КЭ CO ЬхЛ§ЗжЪ§ЕФБфЛЏЧїЪЦ____ЁЃ
ЁОД№АИЁП0.02 +122.54 C ЖўМзУбЕФзЊЛЏТЪИпЃЌЧвВњЮяCO2КЭH2ЕФЬхЛ§ЗжЪ§НЯДѓ AD CH3OCH3(g)+CO2(g)![]() 3CO(g)+3H2(g)
3CO(g)+3H2(g) 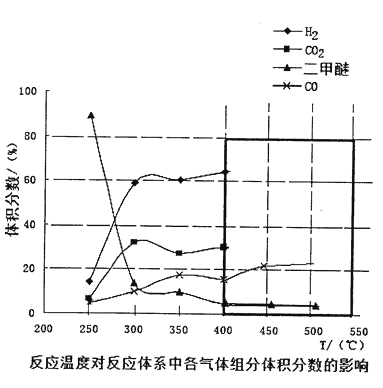
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЗДгІжаИїЮяжЪХЈЖШБфЛЏСПжЎБШЕШгкЦфЛЏбЇМЦСПЪ§жЎБШЫуГіИїЮяжЪЦНКтЪБЕФХЈЖШЃЌШЛКѓИљОнЦНКтГЃЪ§ЖЈвхЫуГіЦНКтГЃЪ§ЃЛ
ЃЈ2ЃЉРћгУИЧЫЙЖЈТЩНтД№ЃЛ
ЃЈ3ЃЉЂйИљОнЗДгІЮяЬхЛ§ЗжЪ§дНЕЭЃЌЦфзЊЛЏТЪдНИпЃЌЩњГЩЮяЬхЛ§ЗжЪ§дНИпЃЌЦфЗДгІбЁдёаддНКУНјааЗжЮіЃЛ
ЂкИљОнЦНКтзДЬЌЯТИїБфСПВЛдйБфЛЏНјааЗжЮіЃЛ
ЂлЖўМзУбгы CO2вдМИКѕЯрЭЌЕФБфЛЏЧїЪЦУїЯдНЕЕЭЃЌЖј CO КЭ H2ЗЂЬхЛ§ЗжЪ§вВвдМИКѕЯрЭЌЕФБфЛЏЧїЪЦЩ§ИпПЩШЗЖЈЗДгІЮягыЩњГЩЮяЃЌИљОндзгЪиКуХфЦНЃЛИљОнИїЮяжЪЕФБфЛЏЧїЪЦКЭЗДгІжаЛЏбЇМЦСПЪ§ЙиЯЕШЗЖЈЧњЯпБфЛЏЁЃ
ЃЈ1ЃЉгЩБэИёЪ§ОнПЩжЊЃЌЗДгІДяЕНЦНКтКѓЃЌn(CH4)=2molЃЌІЄn(CH4)=3mol-2mol=1molЃЌдђЦНКтЪБn(CO2)=4molЁЂn(CO)=2molЁЂn(H2)=2molЃЌГѕЪМЬхЛ§ЮЊ8LЃЌЩшЦНКтЪБЬхЛ§ЮЊVЃЌдђ![]() ЃЌЕУV=10LЃЌИУЗДгІЕФЦНКтГЃЪ§
ЃЌЕУV=10LЃЌИУЗДгІЕФЦНКтГЃЪ§ ЃЛ
ЃЛ
ЃЈ2ЃЉвбжЊЃКЂй CH3OCH3(g)+H2O(l)![]() 2CH3OH(l)ЁїH=+24.52kJ/mol
2CH3OH(l)ЁїH=+24.52kJ/mol
Ђк CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g)ЁїH=+49.01kJ/mol
CO2(g)+3H2(g)ЁїH=+49.01kJ/mol
Ђл CO(g)+H2O(l)![]() CO2(g)+H2(g)ЁїH=-41.17kJ/mol
CO2(g)+H2(g)ЁїH=-41.17kJ/mol
Ђм CH3OH(l)![]() CO(g)+2H2(g)ЁїH=+90. 18kJ/mol
CO(g)+2H2(g)ЁїH=+90. 18kJ/mol
ИљОнИЧЫЙЖЈТЩЂй+Ђк+Ђл+ЂмПЩЕУЃКCH3OCH3(g)+3H2O(l)![]() 2CO2(g)+6H2(g)ЁїH=+122.54kJ/molЃЛ
2CO2(g)+6H2(g)ЁїH=+122.54kJ/molЃЛ
ЃЈ3ЃЉЂйИљОнЭМПЩжЊЃЌ400450ЁцЪБЃЌЖўМзУбЕФзЊЛЏТЪИпЃЌЧвВњЮяCO2КЭH2ЕФЬхЛ§ЗжЪ§НЯДѓЃЌЙЪД№АИЮЊЃКCЃЛЖўМзУбЕФзЊЛЏТЪИпЃЌЧвВњЮяCO2КЭH2ЕФЬхЛ§ЗжЪ§НЯДѓЃЛ
ЂкAЃЎЗДгІЂмЮЊЮќШШЗДгІЃЌзАжУЮЊОјШШЃЌЙЪЬхЯЕЮТЖШЛсНЕЕЭЃЌЦНКтЪБЃЌЬхЯЕЕФЮТЖШВЛдйИФБфЃЌЙЪAЗћКЯЬтвтЃЛ
BЃЎзАжУжаЕФЦјЬхЪМжеЮЊ1ЃК2ЕФCOКЭH2ЃЌЙЪЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЪМжеБЃГжВЛБфЃЌВЛФмЫЕУїЛЏбЇЦНКтзДЬЌЃЌЙЪBВЛЗћКЯЬтвтЃЛ
CЃЎзАжУжаЕФЦјЬхЪМжеЮЊ1ЃК2ЕФCOКЭH2ЃЌЙЪCOЕФЬхЛ§ЗжЪ§ЪМжеВЛБфЃЌВЛФмЫЕУїЛЏбЇЦНКтзДЬЌЃЌЙЪCВЛЗћКЯЬтвтЃЛ
DЃЎИљОн![]() ЃЌЦјЬхЕФзмжЪСПдіДѓЃЌVВЛБфЃЌЙЪЦјЬхЕФУмЖШБЃГжВЛБфЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪDЗћКЯЬтвтЃЛ
ЃЌЦјЬхЕФзмжЪСПдіДѓЃЌVВЛБфЃЌЙЪЦјЬхЕФУмЖШБЃГжВЛБфЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪDЗћКЯЬтвтЃЛ
ЙЪД№АИЮЊЃКADЃЛ
ЂлдкЮТЖШДяЕН400ЁцвдКѓЃЌЖўМзУбгы CO2вдМИКѕЯрЭЌЕФБфЛЏЧїЪЦУїЯдНЕЕЭЃЌЫЕУїЖўМзУбгы CO2ОљзїЗДгІЮяЃЌЧвЖўепЯЕЪ§ЮЊ1:1ЃЌЖј CO КЭ H2ЗЂЬхЛ§ЗжЪ§вВвдМИКѕЯрЭЌЕФБфЛЏЧїЪЦЩ§ИпЃЌЫЕУїCOгыH2зїЩњГЩЮяЃЌЧвЖўепЯЕЪ§ЮЊ1:1ЃЌИљОндзгЪиКуПЩжЊЃЌЗЂЩњЗДгІЃК CH3OCH3(g)+CO2(g)![]() 3CO(g)+3H2(g)ЃЌдђCH3OCH3МѕЩйЃЌЦфЧїЪЦЯТНЕЃЌCOдіЖрЃЌЦфЧїЪЦЩЯЩ§ЃЌЧвБфЛЏБШР§ЮЊ1:3ЃЌЙЪЭМЯѓДѓжТЧїЪЦЮЊЃК
3CO(g)+3H2(g)ЃЌдђCH3OCH3МѕЩйЃЌЦфЧїЪЦЯТНЕЃЌCOдіЖрЃЌЦфЧїЪЦЩЯЩ§ЃЌЧвБфЛЏБШР§ЮЊ1:3ЃЌЙЪЭМЯѓДѓжТЧїЪЦЮЊЃК ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуШнУмБеШнЦїжаЃЌЗДгІ3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)ДяЕНЦНКтЃЌБЃГжЮТЖШВЛБфЃЌМгШыЩйСПЫЎеєЦјЃЌЬхЯЕжиаТДяЕНЦНКтЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
Fe3O4(s)+4H2(g)ДяЕНЦНКтЃЌБЃГжЮТЖШВЛБфЃЌМгШыЩйСПЫЎеєЦјЃЌЬхЯЕжиаТДяЕНЦНКтЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЫЎеєЦјЕФЬхЛ§ЗжЪ§діДѓB.ЧтЦјЕФХЈЖШдіДѓ
C.ЦНКтГЃЪ§БфДѓD.ЬњЕФжЪСПдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкБНЕФа№Ъіе§ШЗЕФЪЧ
A.БНЕФЗжзгЪНЮЊC6H6ЃЌЫќВЛФмЪЙЫсадKMnO4ШмвКЭЪЩЋЃЌЪєгкБЅКЭЬў
B.ДгБНЕФППтРеЪН(![]() )ПДЃЌБНЗжзгжаКЌгаЬМЬМЫЋМќЃЌгІЪєгкЯЉЬў
)ПДЃЌБНЗжзгжаКЌгаЬМЬМЫЋМќЃЌгІЪєгкЯЉЬў
C.БНЕФЭЌЯЕЮяЪЧЗжзгжаНіКЌгавЛИіБНЛЗЕФЫљгаЬўРрЮяжЪ
D.БНЗжзгЮЊЦНУце§СљБпаЮНсЙЙЃЌ6ИіЬМдзгжЎМфЕФМлМќЭъШЋЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщЯжЯѓгыЪЕбщВйзїВЛЯрЦЅХфЕФЪЧ
ЪЕбщВйзї | ЪЕбщЯжЯѓ | |
A | ЯђЪЂгаИпУЬЫсМиЫсадШмвКЕФЪдЙмжаЭЈШызуСПЕФввЯЉКѓОВжУ | ШмвКЕФзЯЩЋж№НЅЭЪШЅЃЌОВжУКѓШмвКЗжВу |
B | НЋУОЬѕЕуШМКѓбИЫйЩьШыМЏТњCO2ЕФМЏЦјЦП | МЏЦјЦПжаВњЩњХЈбЬВЂгаКкЩЋПХСЃВњЩњ |
C | ЯђЪЂгаБЅКЭСђДњСђЫсФЦШмвКЕФЪдЙмжаЕЮМгЯЁбЮЫс | гаДЬМЄадЦјЮЖЦјЬхВњЩњЃЌШмвКБфЛызЧ |
D | ЯђЪЂгаFeCl3ШмвКЕФЪдЙмжаМгЙ§СПЬњЗлЃЌГфЗжеёЕДКѓМг1ЕЮKSCNШмвК | ЛЦЩЋж№НЅЯћЪЇЃЌМгKSCNКѓШмвКбеЩЋВЛБф |
A. AB. BC. CD. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбѕЛЏадЃКBr2 > Fe3+> I2ЃЌЯђКЌ a mol FeI2 КЭ a mol BaCl2 ЕФЛьКЯШмвКжаЛКТ§ЭЈШы b mol Br2ЃЌВЂВЛЖЯНСАшЃЌШмвКжаРызгЕФЮяжЪЕФСПЫц Br2МгШыЕФБфЛЏШчЭМЫљЪО(ВЛПМТЧбЮРрЫЎНтЁЂЫЎЕФЕчРыМАШмвКЬхЛ§БфЛЏ)ЁЃдђЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
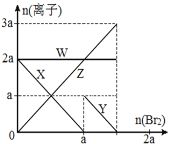
A.РызгЕФЛЙдад I-> Fe2+> Br-
B.ЫФЬѕЯпгыШмвКжаРызгЕФЖдгІЙиЯЕЪЧЃК X-Fe2+ЁЂY-I-ЁЂZ-Br-ЁЂW-Cl-
C.ЕБ4a =3bЪБЃЌЗДгІКѓЕФРызгХЈЖШБШЃКc(Fe2+):c(Fe3+):c(Br-) = 1:2:8
D.ЕБ3aЁм2bЪБЃЌЗЂЩњЕФРызгЗНГЬЪНЃК2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЬўРрЮяжЪЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ЪЏгЭЭЈЙ§МѕбЙЗжСѓПЩвдЕУЕНЯрЖдЗжзгСПНЯДѓЕФЗМЯуЬў
B. БћЯЉгыфхЕФЫФТШЛЏЬМШмвКЗДгІЩњГЩ1,3-ЖўфхБћЭщ
C. ![]() жажСЩйга16ИідзгЙВЦНУц
жажСЩйга16ИідзгЙВЦНУц
D. ![]() ЕФвЛТШДњЮяЕФЭЌЗжвьЙЙЬхга12жж
ЕФвЛТШДњЮяЕФЭЌЗжвьЙЙЬхга12жж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП1923ФъЃЌЮвЙњЛЏбЇМвЮтдЬГѕЯШЩњбажЦГіСЫСЎМлЩњВњЮЖОЋЕФЗНАИЃЌВЂЯђгЂЁЂУРЁЂЗЈЕШЛЏбЇЙЄвЕЗЂДяЙњМвЩъЧыСЫзЈРћЁЃвдЯТЪЧРћгУЛЏбЇЗНЗЈКЯГЩЮЖОЋЕФСїГЬЃК
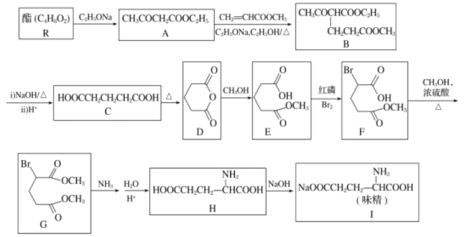
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЯТСагаЙиЕААзжЪКЭАБЛљЫсЕФЫЕЗЈВЛе§ШЗЕФЪЧ____(ЬюзжФИ)ЁЃ
aЃЎЕААзжЪЖМЪЧИпЗжзгЛЏКЯЮя
bЃЎЙШАБЫс(H)здЩэВЛФмЗЂЩњЗДгІ
cЃЎHЗжзгВЛКЌЪжадЬМдзг
dЃЎЬьШЛЕААзжЪЫЎНтзюжеВњЮяЖМЪЧІС-АБЛљЫс
ЃЈ2ЃЉCЕФЯЕЭГУќУћЗЈУћГЦЪЧ____ЃЛBжаКЌбѕЙйФмЭХУћГЦЪЧ____ЁЃ
ЃЈ3ЃЉEЁњFЕФЗДгІРраЭЪЧ____ЁЃRЕФНсЙЙМђЪНЮЊ____ЁЃ
ЃЈ4ЃЉаДГіGКЭNH3ЗДгІЕФЛЏбЇЗНГЬЪНЃК____ЁЃ
ЃЈ5ЃЉTЪЧHЕФЭЌЗжвьЙЙЬхЃЌаДГіЭЌЪБОпБИЯТСаЬѕМўЕФTЕФНсЙЙМђЪН______________ЁЃ
ЂйКЌгаЁЊNH2ЃЌЧвФмЗЂЩњЫЎНтЗДгІЃЛ
Ђк1molTЗЂЩњвјОЕЗДгІФмЩњГЩ4molAg
ЂлКЫДХЙВеёЧтЦзЩЯга4зщЗхЧвЗхУцЛ§БШЮЊ2ЁУ2ЁУ2ЁУ3
ЃЈ6ЃЉВЮееЬтИјСїГЬЭМЃЌвд![]() КЭМзДМЮЊдСЯ(ЦфЫћЮоЛњЪдМСШЮбЁ)ЃЌЩшМЦКЯГЩБНБћАБЫс(
КЭМзДМЮЊдСЯ(ЦфЫћЮоЛњЪдМСШЮбЁ)ЃЌЩшМЦКЯГЩБНБћАБЫс(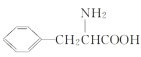 )ЕФСїГЬЃЌаДГіКЯГЩТЗЯп____ЁЃ
)ЕФСїГЬЃЌаДГіКЯГЩТЗЯп____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгЯТСаЪТЪЕЫљЕУГіЕФЯргІНсТле§ШЗЕФЪЧ
ЪЕбщЪТЪЕ | НсТл | |
A | дкЯрЭЌЮТЖШЯТЃЌЯђ1 mL0.2 mol/LNaOHШмвКжаЕЮШы2ЕЮ0.1 mol/LMgCl2ШмвКЃЌВњЩњАзЩЋГСЕэКѓЃЌдйЕЮМг2ЕЮ0.1 mol/LFeCl3ШмвКЃЌгжЩњГЩКьКжЩЋГСЕэ | ШмНтЖШЃКMg(OH)2>Fe(OH)3 |
B | ФГЦјЬхФмЪЙЪЊШѓЕФРЖЩЋЪЏШяЪджНБфКь | ИУЦјЬхЫЎШмвКвЛЖЈЯдМюад |
C | ЭЌЮТЭЌбЙЯТЃЌЕШЬхЛ§pH=3ЕФHAКЭHBСНжжЫсЗжБ№гкзуСПЕФаПЗДгІЃЌХХЫЎЗЈЪеМЏЦјЬхЃЌHAЗХГіЕФЧтЦјЖрЧвЗДгІЫйТЪПь | HBЕФЫсадБШHAЧП |
D | SiO2МШФмгыЧтЗњЫсЗДгІгжФмгыМюЗДгІ | SiO2ЪЧСНадбѕЛЏЮя |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊБНЛЗЩЯгЩгкШЁДњЛљЕФгАЯьЃЌЪЙЯѕЛљСкЮЛЩЯЕФТБдзгЕФЗДгІЛюаддіЧПЃЌЯжгаФГгаЛњЮяЕФНсЙЙМђЪНШчЯТЃК
1molИУгаЛњЮягызуСПЕФЧтбѕЛЏФЦШмвКЛьКЯВЂЙВШШЃЌГфЗжЗДгІКѓзюЖрПЩЯћКФЧтбѕЛЏФЦЕФЮяжЪЕФСПЮЊa(ВЛПМТЧДМєЧЛљКЭЯѕЛљгыЧтбѕЛЏФЦЕФЗДгІЃЌЯТЭЌ)ЃЌШмвКеєИЩЕУЕНЕФЙЬЬхВњЮядйгызуСПЕФИЩдяМюЪЏЛвЙВШШЃЌгжЯћКФЧтбѕЛЏФЦЕФЮяжЪЕФСПЮЊbЃЌдђaЃЌbЗжБ№ЪЧ( )
вбжЊЃК![]()
AЃЎ5molЃЌ10mol BЃЎ6molЃЌ2mol CЃЎ8molЃЌ4mol DЃЎ8molЃЌ2mol
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com