
①分离饱和食盐水与沙子的混合物 | ②分离水和汽油的混合物 | ③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物,CCl4和甲苯互溶 | ④提取出碘水中的碘单质 |
| D | B | C | A |
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、Mg2+、NO3- | B. | Na+、Cl-、I-、SO42- | ||
| C. | H2PO4-、NO-3、NH4+、NO3- | D. | S2O32-,AlO2-,Na+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNO的质量是30g | |
| B. | 标准状况下,1molH2O的体积是22.4L | |
| C. | 17gNH3含有的氢原子总数为6.02×1023 | |
| D. | 100mL0.1mol/L Na2CO3溶液中,Na+的物质的量为 0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
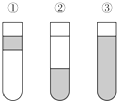 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒清 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题:
光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:$\frac{18}{16}$S | B. | CS2分子的电子式: | ||
| C. | 硫离子(S2-)的结构示意图: | D. | 苯磺酸的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com