
【题目】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__。
Ca5(PO4)3OH(s)![]() 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO![]() (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
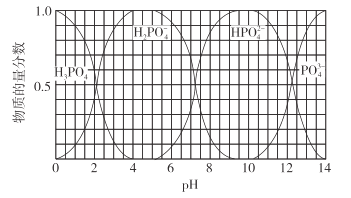
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__(填序号)。
a.Na2HPO4溶液显碱性,原因是HPO![]() 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__。
②该可乐样品中磷酸的含量为__g/L(H3PO4摩尔质量为98g/mol)。
【答案】H3PO4![]() H++H2PO
H++H2PO![]() 可乐为酸性饮料,长期过量饮用,可乐中的酸性物质中和OH-,c(OH-)减小,Ca5(PO4)3OH(s)
可乐为酸性饮料,长期过量饮用,可乐中的酸性物质中和OH-,c(OH-)减小,Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO![]() (aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿 为H3PO4+2OH-=HPO42-+2H2O ab 将可乐中的CO2气体赶出,防止干扰磷酸的测定 0.49
(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿 为H3PO4+2OH-=HPO42-+2H2O ab 将可乐中的CO2气体赶出,防止干扰磷酸的测定 0.49
【解析】
(1)如果H3PO4是强酸,0.1mol·L-1H3PO4溶液的pH<1,现0.1mol·L-1H3PO4溶液大于1,说明H3PO4是弱酸,部分电离,电离方程式为H3PO4![]() H++H2PO4-;
H++H2PO4-;
(2)可乐是酸性饮料,长期过量饮用,可乐中的酸性物质中和了OH-,c(OH-)减小,使Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3PO43-(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿;
5Ca2+(aq)+3PO43-(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿;
(3)①向磷酸溶液中滴加NaOH溶液至pH=10,溶液中含磷的主要微粒,从H3PO4转变为HPO42-,因此主要的离子方程式为H3PO4+2OH-=HPO42-+2H2O;
②a.Na2HPO4溶液中HPO42-既能电离又能水解,电离方程式和水解方程式分别为HPO42-![]() H++PO43-,HPO42-+H2O
H++PO43-,HPO42-+H2O![]() H3PO4+OH-;HPO42-的电离平衡常数
H3PO4+OH-;HPO42-的电离平衡常数![]() ,当c(PO43-)=c(HPO42-)时,溶液中的pH约为12.3,c(H+)=10-12.3mol·L-1,则
,当c(PO43-)=c(HPO42-)时,溶液中的pH约为12.3,c(H+)=10-12.3mol·L-1,则![]() ;HPO42-的水解平衡常数
;HPO42-的水解平衡常数![]() ,当c(H2PO4-)=c(HPO42-)时,溶液中的pH约为7.2,c(H+)=10-7.2mol·L-1,则
,当c(H2PO4-)=c(HPO42-)时,溶液中的pH约为7.2,c(H+)=10-7.2mol·L-1,则![]() ;可知HPO42-的水解程度大于其电离程度,溶液呈碱性,a正确;
;可知HPO42-的水解程度大于其电离程度,溶液呈碱性,a正确;
b.Na2HPO4溶液呈电中性,根据电荷守恒,有c(Na+)+c(H+)=
c.Na2HPO4溶液中,根据物料守恒,有c(Na+)=2[c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)],c错误;
ab符合题意;
(4)①可乐溶液中,含有碳酸,也会与NaOH反应,会影响H3PO4的测定,因此加热的目的是将可乐中的CO2气体赶出,防止干扰磷酸的测定;
②滴定至终点时生成Na2HPO4,则关系式为H3PO4~2NaOH,则50mL可乐中含有![]() ;则该可乐样品中磷酸的含量=
;则该可乐样品中磷酸的含量=![]() 。
。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
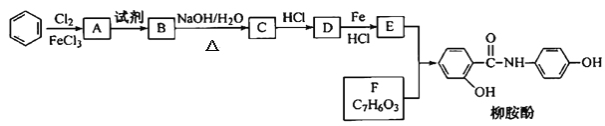
【题目】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
已知:①
② (R为烃基或H原子)
(R为烃基或H原子)
回答下列问题:
(1)对于柳胺酚,下列说法正确的是___(填序号)。
A.1mol柳胺酚最多可以和2molNaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)写出A→B反应所需的试剂___。
(3)写出B→C的化学方程式___。
(4)写出化合物F的结构简式____。
(5)写出同时符合下列条件的F的同分异构体的结构简式___(写出1种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线___(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所得判断正确的是( )
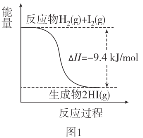
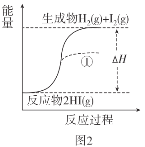
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的鉴别或检验错误的是
A.用激光笔照射区别食盐水和蛋白质溶液
B.向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C.将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D.向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原氮氧化物可防止空气污染。向1L密闭容器加入一定量的活性炭和NO,某温度下发生反应:
已知:①C(s)+2NO(g)![]() N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
②C(s)+O2(g)![]() CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g)![]() 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol
下列说法错误的是
A.ΔH= -574.0 kJ/mol
B.当容器内气体密度不变时,反应①达到平衡状态
C.反应③正反应的活化能大于180.5 kJ/mol
D.反应①达到平衡后,增大压强平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法中正确的是
A.室温下,盐酸中c(Cl-)与醋酸溶液中c(CH3COO-)相等,则两溶液的pH相等
B.将amol·L-1的醋酸溶液与0.01mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),则醋酸的电离常数K=![]() (用含a的代数式表示)
(用含a的代数式表示)
C.向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则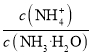 的值减小
的值减小
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
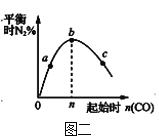
【题目】下列图示与对应的叙述相符的是
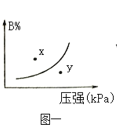

A.图一表示反应:mA(s)+nB(g)![]() pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B.图二表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
C.图三表示对于化学反应mA(g)+nB(g)![]() pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D.图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com