
【题目】用系统命名法写出下列物质名称或结构简式或者对应的化学方程式:
(1) __________
__________
(2)实验室制取乙炔的化学方程式为:___________
(3)乙醇的消去反应:_________________
(4)羧基的结构简式:_______________
【答案】3,3,6-三甲基辛烷 CaC2+2H2O = Ca(OH)2+C2H2↑ CH3CH2OH![]() CH2=CH2↑+H2O -COOH
CH2=CH2↑+H2O -COOH
【解析】
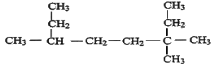
(1)根据烷烃的命名规则,a、选主链,经过碳原子最多的为主链,b、对支链进行编号,从取代基靠近的一端开始编号,c、命名,如图所示编号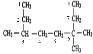 ,故该烷烃的命名为3,3,6-三甲基辛烷,故答案为:3,3,6-三甲基辛烷;
,故该烷烃的命名为3,3,6-三甲基辛烷,故答案为:3,3,6-三甲基辛烷;
(2)实验室制取乙炔是用电石(CaC2)和水反应来制取,故其化学方程式为:CaC2+2H2O = Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O = Ca(OH)2+C2H2↑;
(3)乙醇的消去反应是指乙醇在浓硫酸催化下于170℃下分子内脱水的反应,故反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(4)羧基的电子式为![]() ,故其结构简式:-COOH,故答案为:-COOH。
,故其结构简式:-COOH,故答案为:-COOH。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在酸性介质中,H2O2能使 KMnO4溶液褪色,离子反应(未配平)为:MnO![]() + H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
+ H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
A.氧化性比较:MnO![]() > O2
> O2
B.该反应中酸性介质可以为盐酸
C.氧化剂与还原剂的物质的量之比为2∶5
D.若有0.1 mol氧化产物生成, 则转移电子0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予英国科学家古德纳夫及另外两位科学家,以表彰他们在锂离子电池研究中的杰出贡献。 LiFePO4是用于制备大功率锂离子电池的正极材料 ,且一种制备流程如下:
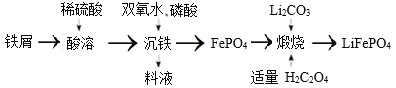
下列有关说法不正确的是
A.LiFePO4中Fe的化合价为+2
B.“沉铁”过程中双氧水作氧化剂
C.料液可循环利用
D.“煅烧”中有大量的CO2 、CO生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
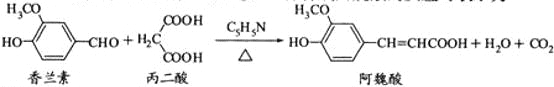
下列说法正确的是
A. 可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() (a).
(a). ![]() (b).
(b). ![]() (c)的分式均为C5H6,下列有关叙述正确的是
(c)的分式均为C5H6,下列有关叙述正确的是
A. 符合分子式为C5H6的同分异构体只有a、b、c三种
B. a、b、c的一氯代物都只有三种
C. a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D. a、b、c分子中的5个碳原子一定都处于同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是_____(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是_______(填化学式),反应的化学方程式为_________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有___________(填序号)。
A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体具有_______性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?_______(填“能”或“不能”),若不能,请填写两种能鉴别的试剂____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com