
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
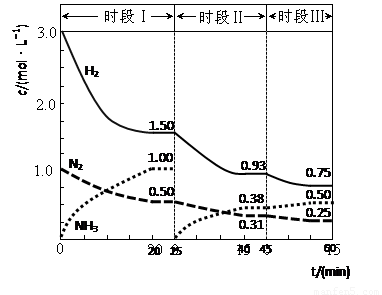
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
△H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g)
△H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)
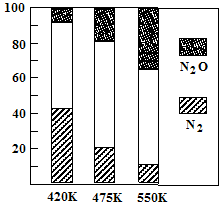
△H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是
,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g)
△H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是
,导致这种规律的原因是 (任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
(16分)有效数字错误或无单位扣1分
(1)①0.050mol•L-1•min-1
(2分)
47.2kJ (2分)
② 将NH3从反应体系中分离出去 (2分)
③ 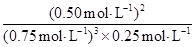 (3分)
(3分)
(2)随温度升高,N2的含量降低 (2分) 主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(2分)
(3)2NH3 + 6OH-—6e-= N2+ 6H2O (3分)
【解析】
试题分析:(1)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L•min),注意保留两位有效数字;氮气由1.0mol/L逐渐减小到0.50mol/L,根据c•V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L1L=0.50mol,由于N2(g)+3H2(g) 2NH3(g)
△H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则
0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[(
0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3
+ 6OH-—6e-= N2+
6H2O,正极反应式为O2+2H2O+4e-=4 OH-。
2NH3(g)
△H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则
0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[(
0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3
+ 6OH-—6e-= N2+
6H2O,正极反应式为O2+2H2O+4e-=4 OH-。
考点:考查化学反应原理,涉及平均反应速率的计算、根据反应物或生成物的变化量计算反应过程中放出的热量、根据反应速率和化学平衡图像判断改变的外界条件、指定阶段下平衡常数的计算表达式、从图中得出温度对平衡移动的影响规律、解释原因、燃料电池的负极反应式等。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
下图表示298K时N2与H2反应过程中的能量变化。根据下图叙述正确的是( )
A.该反应的热化学方程式为:1/2 N2(g)+3/2 H2(g) ![]() NH3(g) △H= -92kJ·mol-1
NH3(g) △H= -92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46KJ
C.加入催化剂,生成 1molNH3的反应热减小50KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示298K时N2与H2反应过程中的能量变化。根据下图叙述正确的是( )
A.该反应的热化学方程式为:1/2 N2(g)+3/2 H2(g) ![]() NH3(g) △H= -92kJ·mol-1
NH3(g) △H= -92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46KJ
C.加入催化剂,生成 1molNH3的反应热减小50KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下图表示298K时N2与H2反应过程中的能量变化。根据下图叙述正确的是( )

A.该反应的热化学方程式为:1/2 N2(g)+3/2 H2(g)  NH3(g) △H= -92kJ·mol-1
NH3(g) △H= -92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学一轮复习《化学家眼中的物质世界》专题综合测试(苏教版) 题型:选择题
下图表示298K时N2与H2反应过程中的能量变化。根据下图叙述正确的是( )

A.该反应的热化学方程式为:1/2 N2(g)+3/2 H2(g)  NH3(g) △H= -92kJ·mol-1
NH3(g) △H= -92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:选择题
下图表示298K时N2与H2反应过程中的能量变化。根据下图叙述正确的是( )

A.该反应的热化学方程式为:1/2 N2(g)+3/2 H2(g)  NH3(g) △H= -92kJ·mol-1
NH3(g) △H= -92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com