
(1)丙烯腈可用“丙烯氨氧化法”生产,生成丙烯腈的热化学方程式为:
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) △H=-515kJ/mol。该法在生产中有多种副产物生成,其中丙烯醛是主要副产物之一。若气态丙烯与氧气反应生成22.4g气态丙烯醛和水蒸汽,同时放出141.2kJ热量,则反应的热化学方程式为:______,该反应在任何温度下都能自发进行,其原因是______。
(2)图(a)为在某一时间段一密闭体系中生成丙烯腈的反应速率与反应进程的曲线关系。由图可知,t1时刻表示体系改变的反应条件为______;t2时刻表示体系改变的另一反应条件为______,此时平衡______移动(填“正向”、“逆向”或“不”)。

(3)图(b)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃ 。在相同的反应时间内,高于460℃时丙烯腈产率降低的可能原因是______(填序号)。
A.平衡常数变大
B.平衡常数变小
C.副反应增多
D.反应活化能增大
在相同的反应时间内.低于460℃时丙烯腈的产率______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________。
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1HA溶液和HB溶液所得滴定曲线如图,下列说法不正确的是

A. Ka(HA)=10-10.8
B. 滴定至P点时,溶液中:c(B-)+c(OH-)<c(HB)+c(H+)
C. 当滴定分别消耗l0mLNaOH 溶液时:c(B-)-c(A-)=c(HA)-c(HB)
D. 当滴定分别消耗20mLNaOH溶液时,将二种溶液混合:c(Na+)>c(B-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
实验室中,从海藻里提取碘的部分流程如下图。下列说法中,不正确的是
A.试剂a可选用酸化的双氧水
B.试剂b可选用酒精
C.步骤③的操作是过滤
D.步骤①需用坩埚,步骤⑤需用分液漏斗
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:选择题
在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol/L、0.15mol/L,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是
A. 0.15mol/L B. 0.225mol/L C. 0.30mol/L D. 0.45mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:推断题
合成光刻胶的一种路线如下:
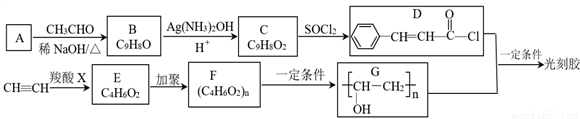

Ⅲ.RCOOH+CH CH RCOOCH=CH2
CH RCOOCH=CH2
回答下列问题
(1)光刻胶中所含官能团的名称是______。
(2)D+G→光刻胶的化学方程式为______,该反应的反应类型是______。
(3)H是C的同分异构体,H具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。则H的结构有______种。其中核磁共振氢谱为5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式为______。
(4)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOC2H5的合成路线流程图(无机试剂任选)。
(合成路线流程图示例如下: )
)
______
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
聚乳酸(PLA)是以有机酸乳酸为原料生产的新型聚酯材料,性能胜于现有塑料聚乙烯、聚丙烯、聚苯乙烯等材料,是新世纪最有发展前途的新型包装材料,是环保材料中的一颗明星。日本钟纺公司以玉米为原料发酵生产聚乳酸,利用聚乳酸制成生物降解性发泡材料。该材料的强度、压缩应力、缓冲性、耐药性等与聚苯乙烯塑料相同,经焚烧后不污染环境,还可肥田。下列说法不正确的是( )
A. 聚乳酸使用后能被自然界中微生物完全降解,最终生成二氧化碳和水,不污染环境
B. 聚乳酸适用于吹塑、热塑等各种加工方法,加工方便,应用十分广泛
C. 聚乳酸(PLA)是一种对环境友好的天然高分子聚酯材料
D. 聚乳酸是以淀粉发酵(或化学合成)得到的,以乳酸为基本原料制备的一种聚酯材料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
在一定条件下,反应A2 + B2  2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
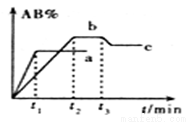
A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:填空题
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子,是产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。人体缺E元素会得软骨病,D与E位于同主族。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C非金属性由强到弱的顺序为________。
(2)B的氢化物的分子式是________,B的氢化物溶于水的电离方程式为
________________________________________________________________________。
(3)写出化合物AC2的电子式:________,它是________(填“极性”或“非极性”)键形成的非极性分子。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市北湖校区高二3月月考化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g)  B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com