
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子,是产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。人体缺E元素会得软骨病,D与E位于同主族。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C非金属性由强到弱的顺序为________。
(2)B的氢化物的分子式是________,B的氢化物溶于水的电离方程式为
________________________________________________________________________。
(3)写出化合物AC2的电子式:________,它是________(填“极性”或“非极性”)键形成的非极性分子。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_________________________________________________。
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 有机物 的名称为2-丁醇
的名称为2-丁醇
B. 蛋白质、淀粉、纤维素都是高分子化合物
C. 合成有机物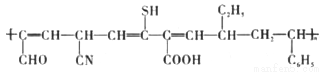 使用的单体有3种
使用的单体有3种
D. 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:填空题
(1)丙烯腈可用“丙烯氨氧化法”生产,生成丙烯腈的热化学方程式为:
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) △H=-515kJ/mol。该法在生产中有多种副产物生成,其中丙烯醛是主要副产物之一。若气态丙烯与氧气反应生成22.4g气态丙烯醛和水蒸汽,同时放出141.2kJ热量,则反应的热化学方程式为:______,该反应在任何温度下都能自发进行,其原因是______。
(2)图(a)为在某一时间段一密闭体系中生成丙烯腈的反应速率与反应进程的曲线关系。由图可知,t1时刻表示体系改变的反应条件为______;t2时刻表示体系改变的另一反应条件为______,此时平衡______移动(填“正向”、“逆向”或“不”)。

(3)图(b)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃ 。在相同的反应时间内,高于460℃时丙烯腈产率降低的可能原因是______(填序号)。
A.平衡常数变大
B.平衡常数变小
C.副反应增多
D.反应活化能增大
在相同的反应时间内.低于460℃时丙烯腈的产率______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:填空题
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则 N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
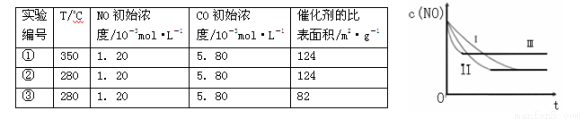
则曲线II对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
①实验组i中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O) αiii (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
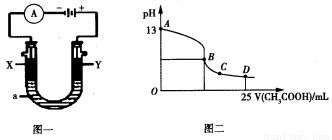
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:选择题
下列实验方案中,不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
D | 验证AgI的溶解度小于AgCl | 将NaI浓溶液加入AgCl悬浊液中,振荡,可观察到沉淀由白色变为黄色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:选择题
下列关于原子结构、元素性质的说法正确的是 ( )
A. 非金属元素组成的化合物中只含共价键
B. ⅠA族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同的质子数和中子数
D. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:选择题
第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )
A. x-8 B. x-18 C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源:海南省、文昌中学2017届高三下学期联考化学试卷 题型:选择题
己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一3月月考化学试卷(解析版) 题型:选择题
一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列说法正确的是 ( )
A. 第七周期有50种元素 B. 该原子的质量数为184
C. 该元素的相对原子质量为292 D. 该原子核外有114个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com