
在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol/L、0.15mol/L,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是
A. 0.15mol/L B. 0.225mol/L C. 0.30mol/L D. 0.45mol/L
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL 0.1000mol/L的两种一元碱MOH、ROH溶液中,PH随盐酸溶液体积的变化如图所示。下列说法正确的是

A. PH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-)
C. 10mL<V(HCl)<20mL时,c(M+)+c(NOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 有机物 的名称为2-丁醇
的名称为2-丁醇
B. 蛋白质、淀粉、纤维素都是高分子化合物
C. 合成有机物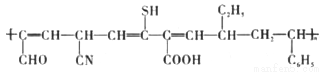 使用的单体有3种
使用的单体有3种
D. 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质相互反应时,水作氧化剂的是
①Na和H2O ②Na2O和H2O ③Fe和H2O(g) ④Na2O2和H2O
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:推断题
有机物E是合成某药物的中间体,化合物E与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构;有机物N可转化为G、F,且生成的G、F物质的量之比为n(G)∶n(F)=1∶3,1 mol G与足量的金属钠反应产生H2 33.6 L(标准状况)。各物质间的转化流程如下(无机产物省略):
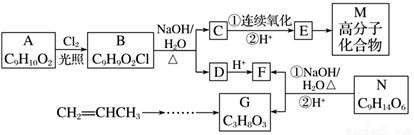
已知:①—ONa连在烃基上不会被氧化;②同一个碳原子上连接2个—OH不稳定。
请回答:
(1)E的结构简式:_______________________。
(2)下列说法不正确的是_________
A.化合物B、F都能发生取代反应
B.化合物A、G都能发生氧化反应
C.一定条件下,化合物F与G反应生成N,还可生成分子组成为C7H12O5和C5H10O4的化合物
D.从化合物A到M的转化过程中,涉及到的反应类型有取代反应、氧化反应、消去反应和缩聚反应
(3)写出B转化为C和D的化学方程式: _________________________。
(4)写出符合下列条件的化合物A的所有同分异构体的结构简式:______________________________。
①含有苯环,且苯环上的一元取代物只有一种
②能与新制氢氧化铜悬浊液反应生成砖红色沉淀,且能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA
B. 0.1mol苯乙烯中含有碳碳双键的数目为0.4NA
C. 4.6g由NO2和N2O4组成的混合气体中含有氧原子的数目为0.2NA
D. 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:填空题
(1)丙烯腈可用“丙烯氨氧化法”生产,生成丙烯腈的热化学方程式为:
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) △H=-515kJ/mol。该法在生产中有多种副产物生成,其中丙烯醛是主要副产物之一。若气态丙烯与氧气反应生成22.4g气态丙烯醛和水蒸汽,同时放出141.2kJ热量,则反应的热化学方程式为:______,该反应在任何温度下都能自发进行,其原因是______。
(2)图(a)为在某一时间段一密闭体系中生成丙烯腈的反应速率与反应进程的曲线关系。由图可知,t1时刻表示体系改变的反应条件为______;t2时刻表示体系改变的另一反应条件为______,此时平衡______移动(填“正向”、“逆向”或“不”)。

(3)图(b)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃ 。在相同的反应时间内,高于460℃时丙烯腈产率降低的可能原因是______(填序号)。
A.平衡常数变大
B.平衡常数变小
C.副反应增多
D.反应活化能增大
在相同的反应时间内.低于460℃时丙烯腈的产率______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:填空题
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则 N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
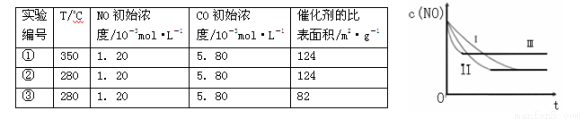
则曲线II对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
①实验组i中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O) αiii (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
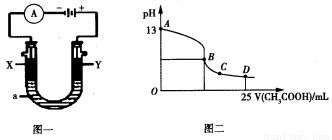
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
查看答案和解析>>
科目:高中化学 来源:海南省、文昌中学2017届高三下学期联考化学试卷 题型:选择题
己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com