
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
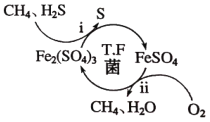
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
【答案】D
【解析】
天然气中的脱硫原理是:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,由此分析;
A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3在整个过程中质量和化学性质不变,可以视为催化剂,故A正确;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3视为催化剂,因此脱硫过程O2间接氧化H2S,总反应为:2H2S+O2=2S+2H2O,故B正确;
C.T.F菌的主要成分为蛋白质,高温下蛋白质会发生变性,因此该脱硫过程不能在高温下进行,故C正确;
D.T.F菌在酸性溶液中可实现天然气的催化脱硫,根据图示,Fe2(SO4)3氧化硫化氢生成硫,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,故D错误;
答案选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
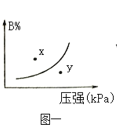

A.图一表示反应:mA(s)+nB(g)![]() pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B.图二表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
C.图三表示对于化学反应mA(g)+nB(g)![]() pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D.图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
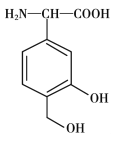
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下列问题。
(1)用系统命名法给下列有机物命名:
①![]() ___________;②
___________;② ___________。
___________。
(2)分子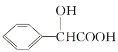 中含有的官能团名称为___________。
中含有的官能团名称为___________。
(3)某有机物分子式为C8H8,且属于芳香烃,已知它可使酸性高锰酸钾溶液和溴水褪色,则该有机物的结构简式为__________。
(4)某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量为88.0,含碳的质量分数为68.2%,含氢的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基,请写出其结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的有机物,下列说法正确的是
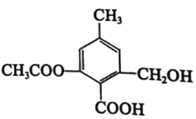
A.分子式为 C10H14O6,属于苯的同系物
B.含有的官能团为羟基、羧基和酯基
C.不能发生取代反应和加成反应,但能发生加聚反应
D.该分子不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和氮的氢化物的任意排放均会对环境造成污染,因此关于其转化的研究对于消除环境污染有着重要意义。
(1)已知T℃时,有如下反应:
反应I:4NH3(g) + 6NO(g)![]() 5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
反应II:N2(g) +2O2(g) ![]() 2NO2(g) △H = +67.8 kJmol-1
2NO2(g) △H = +67.8 kJmol-1
反应III:2NO(g) + O2 (g) ![]() 2 NO2 (g) △H =-116.2 kJmol-1
2 NO2 (g) △H =-116.2 kJmol-1
试写出T℃ 时,NH3与NO2反应生成不污染环境的物质的热化学反应方程式 ______。
(2)T℃时,向2L密闭容器中加入一定量的NO2、NO和O2,发生(1)中反应III,不同时间测得各物质的部分浓度(molL-1) 如下表所示:
时间( min) | NO | O2 | NO2 |
0 | a | 0.30 | 0.10 |
10 | 0.14 | 0.27 | b |
20 | 0.10 | c | 0.20 |
30 | d | 0.24 | 0.22 |
40 | 0.08 | e | f |
①温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比为_______。
②反应的前 20 min 的平均反应速率v(NO)=________molL-1·min-1。
③若温度不变,平衡后将反应容器压缩为1L,达到新的平衡后,c(O2)_____0.48molL-1(填“>”“<”或“ =”)。
(3)某化学兴趣小组利用电解原理设计实验消除NH3 与 NO对环境的影响, 并制取KOH溶液和H2SO4溶液,其工作原理如下图所示:
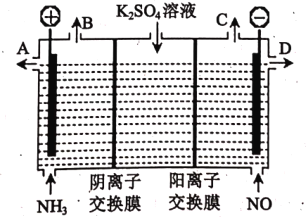
①从出口B、C产生的气体相同,该气体是_____:从出口 D 得到的溶液是____。
②电解槽左池中发生的电极反应式为________ 。
③电解一段时间,两电极共收集到22.4L气体(标准状况下)时,理论上将生成____________mol KOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粘合剂M的合成路线如下图所示:
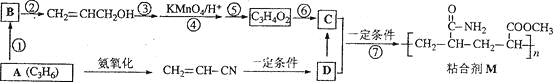
完成下列填空:
1)写出A和B的结构简式。
A___________B_______________
2)写出反应类型。反应⑥______________反应⑦______________
3)写出反应条件。反应②______________反应⑤______________
4)反应③和⑤的目的是____________________。
5)C的具有相同官能团的同分异构体共有________________种。
6)写出D在碱性条件下水解的反应方程式。
____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com