
【题目】A、B、C、D四种有机物分别由碳、氢、氧元素中的两种或三种元素组成各取四种有机物0.1mol,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,D的水溶液显酸性。四种有机物转化关系如图:
![]()
回答下列问题:
(1)A、D分子中所含官能团的名称分别是______、______。
(2)a mol A、B的混合气体完全燃烧,消耗氧气的体积为______(标准状况)。
(3)B→C的化学方程式________,反应类型______。
(4)在实验室里可以用如图所示的装置制取乙酸乙酯。
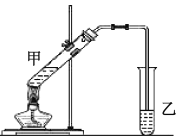
①写出用![]() 与乙酸发生酯化反应的化学方程式_________。
与乙酸发生酯化反应的化学方程式_________。
②反应开始前,试管乙中盛放的试剂为______,制乙酸乙酯时,试管甲中试剂加入顺序为______。
③合成乙酸乙酯的反应为放热反应,实验表明,反应温度应控制在85℃左右为宜。本实验温度不宜低于85℃左右的原因是________。
(5)对所得乙酸乙酯粗产品的提纯过程如下(已知:氯化钙与乙醇生成难溶物)。
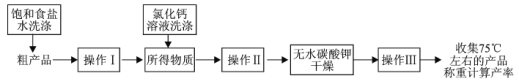
图中操作Ⅰ的名称为_______,操作Ⅱ的名称为_______,操作Ⅲ的名称为_______。
【答案】碳碳双键 羧基 67.2aL 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+C2H518OH
2CH3CHO+2H2O 氧化反应 CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O 饱和碳酸钠溶液 乙醇、浓硫酸、乙酸 温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃ 分液 过滤 蒸馏
CH3CO18OC2H5+H2O 饱和碳酸钠溶液 乙醇、浓硫酸、乙酸 温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃ 分液 过滤 蒸馏
【解析】
(1)![]() (3):0.1mol A、B、C、D四种有机物,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,则分子内均含有2个碳原子,按转化关系
(3):0.1mol A、B、C、D四种有机物,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,则分子内均含有2个碳原子,按转化关系![]() 知,D为连续氧化的产物, 且D的水溶液显酸性,则D乙酸、乙酸可由乙醛氧化所得,则C为乙醛、乙醇催化氧化得乙醛,则B为乙醇、乙烯与水在催化剂作用下发生加成反应得乙醇,则A为乙烯,据此回答;
知,D为连续氧化的产物, 且D的水溶液显酸性,则D乙酸、乙酸可由乙醛氧化所得,则C为乙醛、乙醇催化氧化得乙醛,则B为乙醇、乙烯与水在催化剂作用下发生加成反应得乙醇,则A为乙烯,据此回答;
(4)①结合反应机理写![]() 与乙酸发生酯化反应的化学方程式;
与乙酸发生酯化反应的化学方程式;
②反应开始前,试管乙中盛放的试剂为饱和碳酸钠溶液,制乙酸乙酯时,试管甲中试剂加入顺序要考虑实验安全;
③温度不宜低于85℃左右的原因从温度对速率的影响来分析回答;
(5)乙酸乙酯粗产品中含有可溶于水的乙醇、乙酸,用饱和食盐水洗涤,得互不相溶的两层液体,经分液后得到纯度较高的乙酸乙酯,残留的少量乙醇与氯化钙反应生成难溶物,经过滤后得纯度高的乙酸乙酯,再加入无水碳酸钾固体,可除去残留的水和乙酸,通过蒸馏,就可得乙酸乙酯,据此回答;
(1)据分析A、D分别为乙烯和乙酸,则A、D分子中所含官能团的名称分别是碳碳双键、羧基;
答案为:碳碳双键、羧基;
(2) 据分析A、B分别为乙烯和乙醇,1mol乙烯和乙醇分别燃烧时耗氧量均为3 mol,1mol乙烯和乙醇的混合气体燃烧时耗氧量也为3 mol,则 a mol A、B的混合气体完全燃烧,消耗氧气的体积为3a mol ×22.4L/ mol=67.2 a L(标准状况);
答案为:67.2 a L;
(3) 据分析B、C分别为乙醇和乙醛,则B→C的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型是氧化反应;
2CH3CHO+2H2O,反应类型是氧化反应;
答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应;
2CH3CHO+2H2O;氧化反应;
(4)①酯化反应的机理是酸脱羟基醇去氢,则![]() 与乙酸发生酯化反应的化学方程式为CH3COOH+C2H518OH
与乙酸发生酯化反应的化学方程式为CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
答案为:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
②反应开始前,试管乙中盛放的试剂为饱和碳酸钠溶液,便于除去粗产品中的乙酸和乙醇、形成互不相溶的两层液体;试管甲中试剂加入顺序要考虑实验安全,浓硫酸密度较大,溶于水放出大量的热,因此制取乙酸乙酯时,先加入乙醇,然后边振荡边加入浓硫酸,最后加入乙酸,以防止混合液体溅出,发生危险;
答案为:饱和碳酸钠溶液;乙醇、浓硫酸、乙酸;
③温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
答案为:温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
(5)据分析知,乙酸乙酯粗产品中含有杂质乙醇、乙酸,绝大多数杂质通过饱和食盐水洗涤、经分液后除去,故可得到纯度较高的乙酸乙酯,按信息,残留的少量乙醇与氯化钙反应生成难溶物,经过滤后,得纯度更高的乙酸乙酯,最后用无水碳酸钾固体除去残留乙酸并吸收水,通过蒸馏,就可得纯净的乙酸乙酯;
答案为:分液;过滤;蒸馏。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,如图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+=2Cl+5I2+4H2O。
③![]()

请回答:
(1)比较仪器c和d,实验中c的优点是___。
(2)制备装置甲中需改进的一项措施是___。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是___。
(4)下列有关说法正确的是___。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO2-=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,ClO2的氧化能力是Cl2的2.5倍
(5)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000mol·L1Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I+S4O62-),达到滴定终点时用去20.00mLNa2S2O3标准溶液,测得该水样中ClO2的含量为___mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
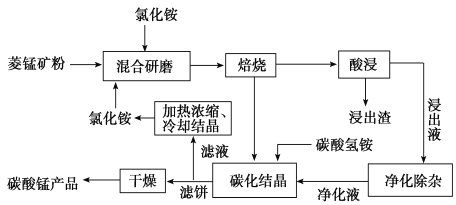
已知:
①菱锰矿的主要成分是![]() ,其中含Fe、Ca、Mg、Al等元素。
,其中含Fe、Ca、Mg、Al等元素。
②![]() 、
、![]() 沉淀完全的pH分别为
沉淀完全的pH分别为![]() 、
、![]() ,
,![]() 、
、![]() 开始沉淀的pH分别为
开始沉淀的pH分别为![]() 、
、![]() 。
。
![]() 焙烧过程中主要反应为
焙烧过程中主要反应为![]() 。
。
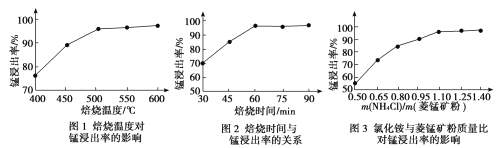
![]() 结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 分别为______、______、______。
分别为______、______、______。
![]() 对浸出液净化除杂时,需先加入
对浸出液净化除杂时,需先加入![]() 将
将![]() 转化为
转化为![]() ,再调节溶液pH的范围为______,将
,再调节溶液pH的范围为______,将![]() 和
和![]() 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入![]() 将
将![]() 、
、![]() 变为氟化物沉淀除去。
变为氟化物沉淀除去。
![]() “碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______。
“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______。
![]() 上述流程中可循环使用的物质是______。
上述流程中可循环使用的物质是______。
![]() 现用滴定法测定浸出液中
现用滴定法测定浸出液中![]() 的含量。实验步骤:称取
的含量。实验步骤:称取![]() g试样,向其中加入稍过量的磷酸和硝酸,加热使反应
g试样,向其中加入稍过量的磷酸和硝酸,加热使反应![]() 充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应
充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应![]() 以除去
以除去![]() ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用![]()
![]() 10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为
10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为![]() ;用
;用![]()
![]() 10.00mL酸性
10.00mL酸性![]() 溶液恰好除去过量的
溶液恰好除去过量的![]() 。
。
![]() 酸性
酸性![]() 溶液与
溶液与![]() 反应
反应![]() 还原产物是
还原产物是![]() 的离子方程式为______。
的离子方程式为______。
![]() 试样中锰的质量分数为______。
试样中锰的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
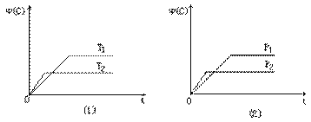
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )

A.电流由O2所在的铂电极流出
B.该电池的负极反应式为:CH3CH2OH+3H2O+12e-═2CO2↑+12H+
C.O2所在的铂电极处发生还原反应
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________,每消耗1molO3,转移___mole-。
(2)计算大气中臭氧的体积分数___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)__→c→__→__→d→__→___。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
仪器A的名称是__;盐酸的体积读数:滴定前读数为__mL,滴定后读数为____mL;

③在G操作中如何确定终点___。
(2)下列操作造成测定结果偏高的是___(填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___。
(2)该草酸溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0③
2H2(g)+O2(g)=2H2O(g) △H4<0④
请回答下列问题:
(1)途径I放出的热量_____________( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是_______________。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。
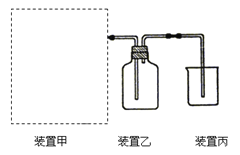
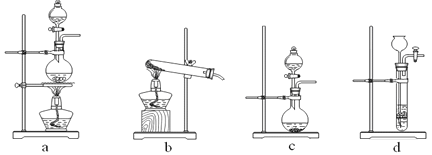
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。
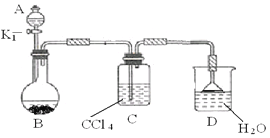
①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
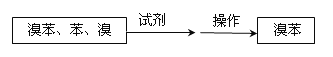
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com