
| A. | 水银 | B. | 石墨 | C. | 硅晶体 | D. | 青铜 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
| 现象 | 结论 | |
| 热水中 | 溶液中有气泡产生,比常温快 | 升高温度,H2O2的分解速率加快 |
| 常温中 | 溶液中有气泡产生,且速度较快 | 无 |
| 冷水中 | 溶液中有气泡产生,比常温慢 | 降低温度,H2O2的分解速率减慢 |
| 现象 | 结论 | |
| 丙加入MnO2 | MnO2能加快化学反应速率 | |
| 乙加入FeCl3 | FeCl3能加快化学反应速率 | |
| 甲不加其他试剂 | 溶液中有少量气泡出现 | 不使用催化剂化学反应速率较小 |
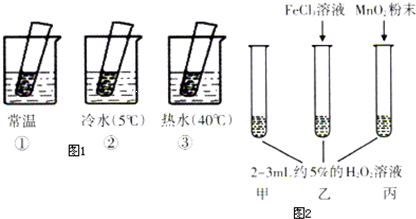
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失电子能力比Na的强 | |
| C. | 砹(At)是第VIIA族,其氢化物的稳定性大于HCl | |
| D. | 第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
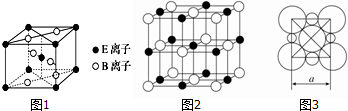
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com