
| X | Y | |
| Z | W |
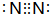 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;分析 由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,据此解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl.
(1)W为Cl元素,处于周期表中第三周期第ⅦA族,故答案为:三;ⅦA;
(2)X为N元素,形成的双原子分子为N2,其电子式是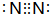 ;Y为O元素,和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;Z为S元素,和氢元素形成的18电子微粒中常见的-1价阴离子为HS-,
;Y为O元素,和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;Z为S元素,和氢元素形成的18电子微粒中常见的-1价阴离子为HS-,
故答案为: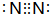 ;H3O+;HS-;
;H3O+;HS-;
(3)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl;
(4)在一定条件下,元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质,反应方程式为:2SO2+O2?2SO3,反应时每转移4mol电子放热190.0kJ,则参加反应二氧化硫为$\frac{4mol}{2}$=2mol,该反应的热化学方程式是:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1,
故答案为:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,较好的考查学生运用知识分析问题、解决问题的能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
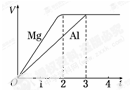 一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )
一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:3 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
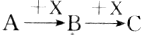 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华时破坏了共价键 | |
| B. | PH3沸点低于NH3沸点,因为P-H键键能低 | |
| C. | HF的分子间作用力(含有氢键)大于HCl,故HF比HCl更稳定 | |
| D. | 氯化钠固体中的离子键在溶于水时被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com