
下列离子方程式正确的是
A.NO2通入AgNO3溶液中:3NO2+H2O=2NO3-+NO+2H+
B.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
C.过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-=NH3·H2O
D.铜片加入稀HNO3中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届江苏省沭阳县高一下学期期中调研测试化学试卷(解析版) 题型:选择题
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
A.铊是易导电的银白色金属 B.能生成+3价离子化合物
C.T1(OH)3是两性氢氧化物 D. Tl的失电子能力比Al强
查看答案和解析>>
科目:高中化学 来源:2016届广东省东莞市四校高一下学期期中联考化学试卷(解析版) 题型:选择题
下列关于离子化合物的叙述正确的是:
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物如能溶于水,其水溶液一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高一下学期期中考查化学试卷(解析版) 题型:选择题
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质不可能是
A.Zn和浓H2SO4 B.C和浓HNO3 C.Na2O2和NH4Cl浓溶液 D.Cu和浓HNO3
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高一下学期期中考查化学试卷(解析版) 题型:选择题
下列所用的酸在反应中同时表现酸性和氧化性的是
A.用浓盐酸与KMnO4反应制取Cl2
B.向蔗糖中加入浓H2SO4,固体变黑膨胀
C.用稀硫酸与CuO反应制取胆
D.用浓硝酸除去铝表面的铜镀层
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步课时作业(必修1苏教版)4.1.2硫酸的性质和使用 题型:实验题
某学习小组进行浓硫酸对蔗糖的脱水实验,“在200 mL烧杯中放入20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%的浓硫酸,迅速搅拌”进行如下探究。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。按压此黑色物质时,感觉较硬,放在水中呈漂浮状态。
同学们由上述现象推测出下列结论:①浓硫酸具有强氧化性;②浓硫酸具有吸水性;③浓硫酸具有脱水性;④浓硫酸具有酸性;⑤黑色物质具有强吸附性,其中依据不充分的是 (填序号)。
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
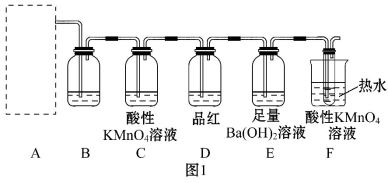
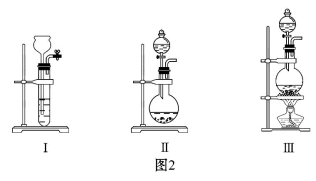
试回答下列问题:
①图1的A中最好选用图2中的装置 (填编号)。
②图1的B装置所装试剂是 ;D装置中试剂的作用是 ;
E装置中发生的现象是 。
③图1的A装置中使蔗糖先变黑的化学反应方程式为
;
后体积膨胀的化学方程式为
。
④某学生进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因
。
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步课时作业(必修1苏教版)4.1.2硫酸的性质和使用 题型:实验题
下面是某同学在学习硫元素时的学习方案,请完善该同学的学习方案。
(1)硫原子的结构:硫原子的核内质子数为16,它的原子结构示意图是 ,从结构可以知道硫元素是一种典型的非金属元素。
(2)硫单质的物理性质:硫是一种淡黄色的 体(填“气”“液”或“固”),主要存在于火山喷发口附近或地壳的岩层里,这是硫以游离态形式存在于自然界中。硫元素在自然界中也有以化合态形式存在的,如许多金属矿石是含硫化合物,如胆矾 (填化学式)。
(3)设计如下实验探究硫和含硫化合物的相互转化:
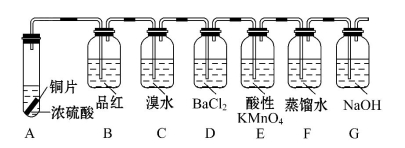
(Ⅰ)完成下列各个反应的化学方程式
①A中在加热时发生的反应
。
②C中的反应
。
(Ⅱ)记录观察到的实验现象
①B中品红溶液由红色变为 ,加热后又 ,(结论:可以根据该现象用品红溶液来证明SO2的存在与否)。
②D中没有观察到什么现象,在实验结束后往D中滴加H2O2后则可以看到 。
③E中溶液由紫红色变为无色,反应的离子方程式是
2Mn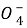 +5SO2+2H2O====2Mn2++5S
+5SO2+2H2O====2Mn2++5S +4H+
+4H+
反应中SO2是 剂(填“氧化”或“还原”)。
(Ⅲ)G的作用是吸收尾气,写出反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步课时作业(必修1苏教版)3.1.1铝及铝合金 题型:计算题
现有镁铝合金共3.9克,与500 mL 2 mol·L-1盐酸(足量)反应,生成的气体在标准状况下体积为4.48 L,若反应后所得溶液的体积仍为500 mL,求:
(1)镁铝合金中铝的物质的量。
(2)镁铝合金中镁的质量分数。
(3)反应后溶液中Cl-的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步作业(必修1苏教版)4.1.1二氧化硫的性质和应用 题型:选择题
下列说法不正确的是 ( )
A.从性质的角度分类,SO2属于酸性氧化物
B.从元素化合价的角度分类,SO2既可作氧化剂又可作还原剂
C.从在水中是否发生电离的角度,SO2属于电解质
D.从对大气及环境影响的角度,SO2是一种大气污染物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com