
【题目】将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是( )
A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL
B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下)
C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol
D.参加反应的金属的总质量一定是9.9g
【答案】AC
【解析】解:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 , 沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为 ![]() =0.45mol,则镁和铜的总的物质的量为0.225mol,
=0.45mol,则镁和铜的总的物质的量为0.225mol,
A.当生成的沉淀达到最大量时,溶液中溶质为NaNO3 , 硝酸根守恒可知n(NaNO3)=2n(硝酸铜+硝酸镁)=0.225mol×2=0.45mol,由钠离子守恒由n(NaOH)=n(NaNO3)=0.45mol,故此时氢氧化钠溶液的体积为 ![]() =0.15L=150mL,故A正确;
=0.15L=150mL,故A正确;
B.根据电子转移守恒可知生成的NO物质的量为 ![]() =0.15mol,标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,故B错误;
=0.15mol,标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,故B错误;
C、根据氮元素守恒n(HNO3)=2n(硝酸铜+硝酸镁)+n(NO)=0.225mol×2+0.15mol=0.6mol,故C正确;
D、镁和铜的总的物质的量为0.225mol,假定全为镁,质量为0.225mol×24g/mol=5.4g,若全为铜,质量为0.225mol×64g/mol=14.4g,所以参加反应的金属的总质量(m)为5.4g<m<14.4g,故D错误;
故选AC.


科目:高中化学 来源: 题型:
【题目】(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其正极反应式为 _________________________________。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)_________________
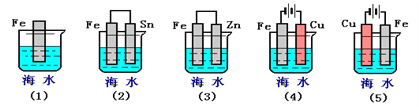
(Ⅲ)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
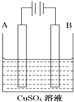
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是_______________________。
②镀层破损后,镀铜铁比镀锌铁更_______被腐蚀(填“容易”“不容易”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、NH3、O2混合气体共1.2mol,通过稀硫酸后溶液质量增加45g,气体体积缩小为2.24L(标况),将带火星的木条插入其中,木条不复燃,原混合气体的平均相对分子质量为( )
A.46
B.40
C.37.5
D.17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,有下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
A. 缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动
B. 将1 mol N2和3 mol H2充分反应达到平衡时,放出的热量等于93.4 kJ
C. 催化剂能缩短该反应达到平衡所需的时间,从而提高N2的转化率
D. 若混合气体中各成分的浓度不再变化,则该反应已达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
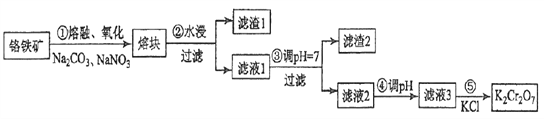
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
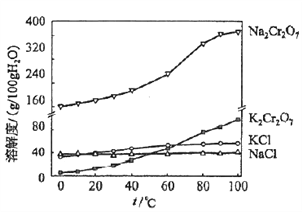
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬常来减轻感冒症状,其结构简式如图,下列有关说法正确的是( )
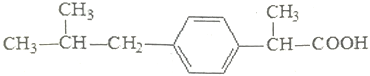
A. 布洛芬的分子式为C13H17O2 B. 布洛芬在核磁共振氢谱中呈现出10种峰
C. 布洛芬与苯乙酸是同系物 D. 布洛芬在苯环上发生取代反应,其一氯代物存4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某原电池装置,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( ) 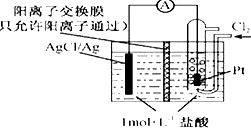
A.正极反应为AgCl+e﹣═Ag+Cl﹣
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e﹣时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com