
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
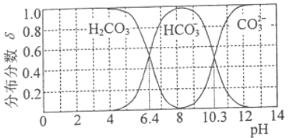
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
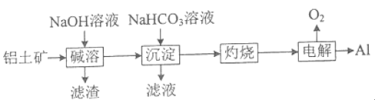
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
【答案】BD 1.4×104 ![]() +H2O
+H2O![]()
![]() +OH- 3.7 B>C>A Fe2O3
+OH- 3.7 B>C>A Fe2O3 ![]() +OH-=
+OH-=![]() +H2O
+H2O ![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
【解析】
(1)依据盐类水解规律、电荷守恒和物料守恒分析可得;
(2)当两种沉淀共存时,溶液中硫酸根和碳酸根的浓度之比等于硫酸钙和碳酸钙的溶度积之比;
(3)当c(H2CO3)=c( )时,一级电离平衡常数等于溶液中氢离子浓度,当c(
)时,一级电离平衡常数等于溶液中氢离子浓度,当c(![]() )= c(
)= c(![]() )时,二级电离平衡常数等于溶液中氢离子浓度,碳酸根的水解平衡常数等于水的离子积常数除以二级电离平衡常数,通过比较电离平衡常数的大小,判断盐的水解程度大小;
)时,二级电离平衡常数等于溶液中氢离子浓度,碳酸根的水解平衡常数等于水的离子积常数除以二级电离平衡常数,通过比较电离平衡常数的大小,判断盐的水解程度大小;
(4)由流程可知,向铝土矿中加入氢氧化钠溶液,两性氧化物氧化铝和酸性氧化物能与氢氧化钠溶液反应,碱性氧化物氧化铁与氢氧化钠溶液不反应,其中二氧化硅转化为铝硅酸钠沉淀,氧化铝转化为偏铝酸钠溶液,过滤得到偏铝酸钠和氢氧化钠的混合溶液;向混合溶液中加入碳酸氢钠溶液,碳酸氢钠溶液先与氢氧化钠溶液反应,再与偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸钠,过滤得到氢氧化铝沉淀;灼烧氢氧化铝,氢氧化铝分解生成氧化铝,电解熔融的氧化铝制得金属铝。
(1)A.0.1mol·L-1的Na2CO3溶液中存在电荷守恒关系c(Na+)+ c(H+) =c(OH-)+c(![]() )+2c(
)+2c(![]() ),故错误;
),故错误;
B.0.1mol·L-1的NaHCO3溶液中存在物料守恒关系 c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3),故正确;
)+ c(H2CO3),故正确;
C.0.1mol·L-1的NaHCO3溶液中,![]() 的水解程度大于电离程度,溶液呈碱性,则c(H2CO3)> c(
的水解程度大于电离程度,溶液呈碱性,则c(H2CO3)> c(![]() ),故错误;
),故错误;
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液中电荷守恒关系c(Na+)+c(H+) =c(OH-)+c(![]() )+2c(
)+2c(![]() ),还存在物料守恒关系2c(Na+) =3c(
),还存在物料守恒关系2c(Na+) =3c(![]() ) +3 c(
) +3 c(![]() )+ 3c(H2CO3),整合电荷守恒关系和物料守恒关系可得2c(H+)+c(
)+ 3c(H2CO3),整合电荷守恒关系和物料守恒关系可得2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() ),故正确;
),故正确;
故答案为:BD;
(2)当两种沉淀共存时, 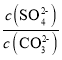 =
=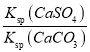 =
=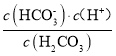 =
=![]() =1.4×104,故答案为:1.4×104;
=1.4×104,故答案为:1.4×104;
(3)碳酸的一级电离平衡常数Ka1=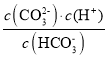 ,由图可知pH=6.4时,c(H2CO3)=c(
,由图可知pH=6.4时,c(H2CO3)=c( ),Ka1=1.0×10-6.4,二级电离平衡常数Ka2=
),Ka1=1.0×10-6.4,二级电离平衡常数Ka2=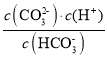 ,由图可知pH=10.3时,c(
,由图可知pH=10.3时,c(![]() )= c(
)= c(![]() ),则Ka2=1.0×10-10.3;
),则Ka2=1.0×10-10.3;
①碳酸钠是强碱弱酸盐,![]() 在溶液中水解使溶液呈碱性,碱性条件下,油脂水解达到除油污的目的,碳酸是二元弱酸,碳酸根在溶液中分步水解,以一级水解为主,则水解的离子方程式为
在溶液中水解使溶液呈碱性,碱性条件下,油脂水解达到除油污的目的,碳酸是二元弱酸,碳酸根在溶液中分步水解,以一级水解为主,则水解的离子方程式为![]() +H2O
+H2O![]()
![]() +OH-,25℃时,该反应的平衡常数表示为Kh=
+OH-,25℃时,该反应的平衡常数表示为Kh=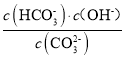 =
=![]() =
=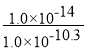 =1.0×10-3.7,则pKh=3.7,故答案为:
=1.0×10-3.7,则pKh=3.7,故答案为:![]() +H2O
+H2O![]()
![]() +OH-;3.7;
+OH-;3.7;
②酸越强,电离平衡常数越大,由电离平衡常数可知,电离程度H2CO3>HCN>![]() ,酸的电离程度越大,对应盐的水解程度越小,水解程度
,酸的电离程度越大,对应盐的水解程度越小,水解程度![]() >CN—>
>CN—>![]() ,则浓度均为.0.1mol·L-1的NaHCO3溶液、Na2CO3溶液和NaCN溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>NaHCO3溶液,故答案为:B>C>A;
,则浓度均为.0.1mol·L-1的NaHCO3溶液、Na2CO3溶液和NaCN溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>NaHCO3溶液,故答案为:B>C>A;
(4)①由分析可知,滤渣中除含铝硅酸钠外,还含有氧化铁,故答案为:Fe2O3;
②“沉淀”步骤时,碳酸氢钠溶液先与氢氧化钠溶液反应,再与偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式分别为![]() +OH-=
+OH-=![]() +H2O和
+H2O和![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]() ,故答案为:
,故答案为:![]() +OH-=
+OH-=![]() +H2O;
+H2O;![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O
+6H+=2S↓+3H2O
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL0.20mol·L-1的KCl溶液,实验操作如下:
A. 用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
B. 加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
C .将KCl溶液由烧杯小心倒入100mL容量瓶中;
D .然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
E.使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____________(填写字母序号)。
(2)下面哪些操作会导致所配的100mL0.20mol/L的KCl溶液浓度降低___________。
A 容量瓶用蒸馏水洗涤三次直到洗净 B 称量KCl固体时将砝码放在左盘
C 未洗涤转移KCl溶液的烧杯 D 转移KCl溶液时有KCl溶液溅出
E 定容时仰视刻度线
(3)若用0.2mol·L-1的KCl溶液配制0.05mol·L-1的KCl溶液200.0mL,需要0.20mol·L-1的KCl溶液____________mL。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)
A ![]() B
B ![]() C
C ![]()
![]() D
D ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaOH溶液:Na+、K+、![]() 、
、![]()
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、SCN-、
、SCN-、![]()
C.0.1mol·L-1Na2S溶液:Na+、K+、ClO-、OH-
D.0.1mol·L-1NH4HCO3溶液:Ba2+、K+、OH-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.l mol·L-1的溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如下图所示。下列有关离子浓度关系叙述一定正确的是( )
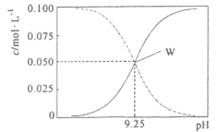
A.W点表示溶液中:c(NH3·H2O)+c(H+)=c(Cl-)+c(OH-)
B.pH=7.0溶液中: c(NH3·H2O)>c(NH4+)>c(OH-)=c(H+)
C.pH=10.5的溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
D.向W点所表示的1 L溶液中加入0.05 mol NaOH固体(忽略溶液体积变化):c(Na+)>c(Cl-)>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸( )极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
)极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
A.过二硫酸与高锰酸钾溶液反应可产生氧气
B.过二硫酸铵溶于水所得溶液显酸性
C.将过二硫酸加入滴有紫色石蕊试液的水中,溶液显红色
D.过二硫酸可用来除去稀硫酸中的亚硫酸杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是重要的生物质能,主要由有机废弃物发酵产生,其成分有CH4、CO2和H2S等,由沼气获得高纯度CH4的工作原理如图所示(交换膜左侧为酸性溶液,右侧为碱性溶液),下列说法中错误的是
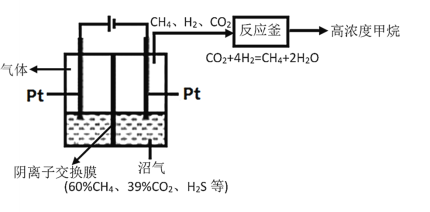
A.对沼气池进行检修时应预先通风并戴防毒面具
B.阴离子应从左侧向右侧迁移
C.在阳极上可能发生反应:HS--2e-=S↓+H+
D.一定条件下反应釜中的反应能自发进行,主要原因是该反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是( )
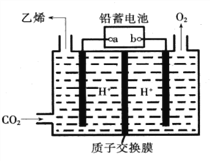
A. b为铅蓄电池的正极
B. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
C. 电解过程中,阳极区溶液中c(H+)逐渐减小
D. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com