
【题目】过二硫酸( )极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
)极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
A.过二硫酸与高锰酸钾溶液反应可产生氧气
B.过二硫酸铵溶于水所得溶液显酸性
C.将过二硫酸加入滴有紫色石蕊试液的水中,溶液显红色
D.过二硫酸可用来除去稀硫酸中的亚硫酸杂质
【答案】C
【解析】
已知过二硫酸极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,
A. 由于过二硫酸在水中会逐渐水解得到过氧化氢,而过氧化氢可被高锰酸钾氧化产生氧气,故过二硫酸与高锰酸钾溶液反应可产生氧气,故A正确;
B. 根据过二硫酸的水解反应可知,![]() 发生水解反应为
发生水解反应为![]() + 2H2O=H2O2 + 2
+ 2H2O=H2O2 + 2![]() ,水解产生
,水解产生![]() 发生电离:
发生电离:![]() =H++
=H++![]() ,铵根水解也使溶液显酸性,故过二硫酸铵溶于水所得溶液显酸性,故B正确;
,铵根水解也使溶液显酸性,故过二硫酸铵溶于水所得溶液显酸性,故B正确;
C. 由于过二硫酸在水中会逐渐水解得到过氧化氢,而过氧化氢具有漂白性,可以使紫色石蕊试液褪色,故将过二硫酸加入滴有紫色石蕊试液的水中,溶液褪色,故C错误;
D. 由于过二硫酸在水中会逐渐水解得到过氧化氢,而过氧化氢具有氧化性,能将亚硫酸氧化为硫酸,故过二硫酸可用来除去稀硫酸中的亚硫酸杂质,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】阿司匹林的有效成分是乙酰水杨酸(![]() )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
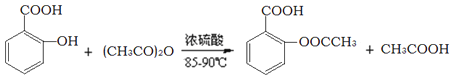
操作流程如下:

已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是______________。
(2)提纯粗产品流程如下,加热回流装置如图:
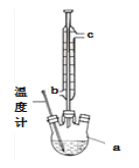
①沸石的作用是_______________;
②冷凝水的流出方向是____________(填“b”或“c”);
③使用温度计的目的是____________。
(3)检验最终产品中是否含有水杨酸的化学方法是_________________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式______________。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min B的浓度减少0.6 molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 molL-1min-1
B.2min末的反应速率v(C)=0.2 molL-1min-1
C.2min内D的物质的量增加0.2mol
D.若起始时A、B的物质的量之比为4∶3,则2 min末A、B的转化率之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电钠-CO2 电池示意图如下,放电时电池总反应为: 4Na+3CO2=2Na2CO3+C.下列说法正确的是
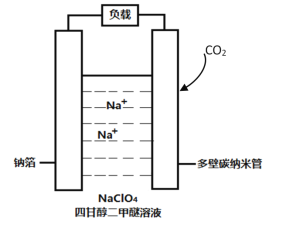
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++ 3CO2+ 4e- = 2Na2CO3+C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1molCO2,理论上电路中转移4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
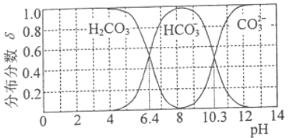
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
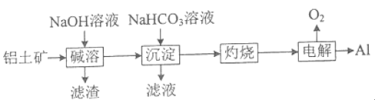
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
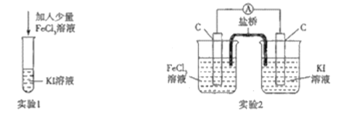
A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2
B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应
C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应
D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
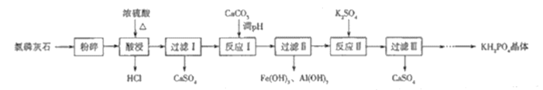
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
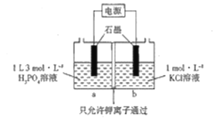
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 工业上用电解法制备烧碱: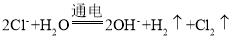
B. 用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑
C. NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
D. 铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com