
【题目】(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在电极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-。
已知:正极反应式:O2-4e-=2O2-。
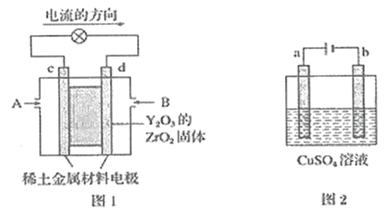
则:c电极的名称为__,d电极上的电极反应式为__。
(2)如图2所示,用惰性电极电解100mL0.5molL-1CuSO4溶液,a电极上的电极反应式为__,若a电极产生56mL(标准状况)气体,则所得溶液的pH=_(不考虑溶液体积变化)。
【答案】正极 CH4+4O2--8e-=CO2+2H2O 4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑ 1
【解析】
(1)依据装置图中电流流向分析,c为正极,氧气得电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
(2)图乙是电解池,与电源正极连接的a电极为阳极,电极反应为4OH--4e-=O2↑+2H2O,b为阴极,电极反应为Cu2++2e-=Cu,结合电极方程式计算。
(1)图甲是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生氧化反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4-8e-+4O2-=CO2+2H2O;
(2)如图乙所示电解100mL0.5molL-1CuSO4溶液,发生的电解总反应为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,与电源正极相连的a极为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:2H2O-4e-=4H++O2↑或者4OH--4e-=2H2O+O2↑;若a电极产生56mL(标准状况)氧气,氧气物质的量为0.0025mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
2Cu+O2↑+2H2SO4,与电源正极相连的a极为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:2H2O-4e-=4H++O2↑或者4OH--4e-=2H2O+O2↑;若a电极产生56mL(标准状况)氧气,氧气物质的量为0.0025mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=![]() =0.1mol/L,pH=-lg0.1=1。
=0.1mol/L,pH=-lg0.1=1。


科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
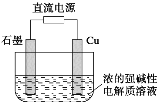
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如下:
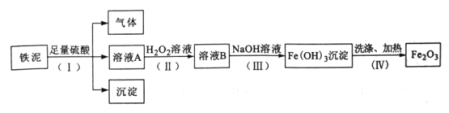
(1)步骤(I)中生成的气体是_____,溶液A和沉淀分离的操作名称是_______。
(2)步骤(Ⅱ)中加入H2O2溶液后,Fe2+被____(填“氧化”或“还原")成Fe3+。
(3)步骤(Ⅲ)中生成Fe(OH)3沉淀的颜色是_______(填“白色”或“红褐色")。
(4)步骤(IV)中Fe(OH)3受热分解生成Fe2O3和H2O的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示有关说法正确的是
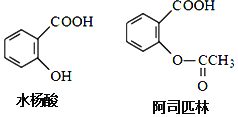
A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.水杨酸可以发生取代、加成、氧化、加聚反应
D.1mol阿司匹林最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下体积为1mL、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为VmL,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
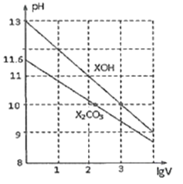
A.VOH为弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.当lgV=3时,XOH溶液中由水电离的OH-的浓度为10-10mol/L
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒给世界人民的生活和工作带来严重威胁。医用酒精、过氧乙酸![]() 、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
A.酒精浓度越高杀灭病毒效果越好
B.杀灭病毒原理相同
C.过氧乙酸中含有过氧键
D.酒精和84消毒液混合施用效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Fe(OH)3 溶于HI溶液: 2Fe(OH)3+6H++2I- =2Fe2++I2+6H2O
B.向NaAlO2溶液中通入过量CO2: 2![]() +CO2+3H2O = 2Al(OH)3↓+
+CO2+3H2O = 2Al(OH)3↓+![]()
C.向[Ag(NH3)2]OH溶液中加入足量盐酸生成白色沉淀: [Ag(NH3)2]+ + Cl-= AgC1↓+ 2 NH3↑
D.向K2MnO4溶液中加入醋酸生成KMnO4和MnO2: 3![]() + 4H+= MnO2↓+ 2
+ 4H+= MnO2↓+ 2![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献,![]() 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________形。
(2)![]() 中
中![]() 的配位数为4。
的配位数为4。
①配体中![]() 原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
②![]() 的立体构型是________;与
的立体构型是________;与![]() 互为等电子体的分子和离子为________(各写一种)。
互为等电子体的分子和离子为________(各写一种)。
(3)![]() 是钴的重要化合物。
是钴的重要化合物。![]() 键角小于
键角小于![]() 的键角,原因是________。
的键角,原因是________。
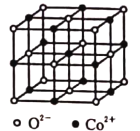
(4)一氧化钴的晶胞如图所示,在每个![]() 的周围与它距离最近的
的周围与它距离最近的![]() 共有________个,若
共有________个,若![]() 晶体的密度为
晶体的密度为![]() ,则晶体中
,则晶体中![]() 与
与![]() 之间的最小距离为________
之间的最小距离为________![]() 。(用含
。(用含![]() 和
和![]() 的代数式表示。
的代数式表示。![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com