
【题目】关于如图所示装置的说法错误的是( )
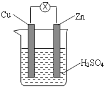
A. 锌片发生氧化反应
B. 铜片周围溶液变为蓝色
C. 电子由锌片通过外电路流向铜片
D. 溶液中SO42-向负极方向流动
【答案】B
【解析】
该装置是原电池,锌作负极,铜作正极,负极上失电子发生氧化反应,正极上氢离子得电子发生还原反应,电流从正极沿导线流向负极,电解质溶液中阳离子向正极移动,阴离子移向负极。
A. 该装置是原电池,锌作负极,铜作正极。电子从锌片沿导线流向铜片,发生了氧化反应,故A选项正确;B.正极铜片上,氢离子得电子发生还原反应而生成氢气,铜不反应,铜片周围溶液不会变为蓝色,故B错误;C.该原电池中,锌是负极,负极上锌失电子生成锌离子进入溶液,电子沿导线流向铜片,故C选项正确;D.电解质溶液中阳离子向正极铜片方向移动,阴离子移向负锌片方向移动,所以溶液中SO42-向负极方向流动,故D选项正确;所以答案为B。


科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中加入金属锌有H2放出,则在该溶液中一定能大量共存的是( )
A.Cu2+ Cl﹣ K+ SO42﹣
B.Na+ NO3﹣ OH ﹣ CO32﹣
C.Ba2+ Cl﹣ NO3﹣ SO42﹣
D.K+ Na+ Cl﹣ SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
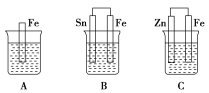
(1)A中反应的离子方程式为_____________________________________。
(2)B中Sn极的电极反应式为___________________________________。
(3)C中被反应掉的金属是________,总反应的化学方程式为_________,比较A、B、C中铁反应的速率,由快到慢的顺序为____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ![]() 溶液是检验
溶液是检验![]() 的试剂,若溶液中存在
的试剂,若溶液中存在![]() ,将产生蓝色沉淀。将
,将产生蓝色沉淀。将![]() 的KI溶液和
的KI溶液和![]()
![]() 溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“
溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“![]() ”的是
”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ① B. ②和④ C. ③和④ D. ①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:![]()
![]()
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________。
①![]()
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将![]() 和
和![]() 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, ![]() 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, ![]() 代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。
代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。

(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%的是__________。
的体积分数仍为a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 电离方程式为___________,向
电离方程式为___________,向![]() 溶液中加入
溶液中加入![]() 固体,则电离平衡往__________反应方向移动。
固体,则电离平衡往__________反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
C. SiO2![]() SiCl4
SiCl4![]() Si
Si
D. N2![]() NH3
NH3![]() NH4Cl(aq)
NH4Cl(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
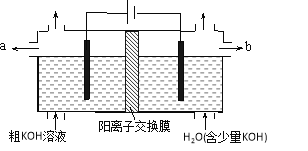
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。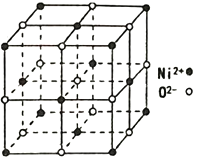
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com