

实验过程如下:在120℃;时,将装置A中的x气体缓缓通过已排尽空气并装有氧化铜的装置B,反应后在装置C中收集到水,装置D中收集到氮气。
装置B中黑色粉末变为红色光亮的粉末,并测得x反应了240mL,氧化铜质量减少了0.32g。
(1)240mL气体x完全反应后,装置E中收集到水240mL,测得1mol x气体的体积是24000 mL,则x的摩尔质量为________;x的化学式是________;(气体体积均换算成相同状况下的体积);
(2)B中发生化学反应的方程式是________(假设x在该条件下不分解)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:058
下图是用于测定含两种元素的某种气体x的化学式的实验装置图。
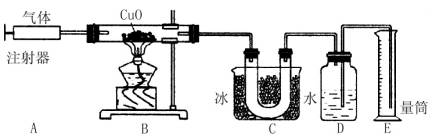
实验过程如下:在120℃;时,将装置A中的x气体缓缓通过已排尽空气并装有氧化铜的装置B,反应后在装置C中收集到水,装置D中收集到氮气。
装置B中黑色粉末变为红色光亮的粉末,并测得x反应了240mL,氧化铜质量减少了0.32g。
(1)240mL气体x完全反应后,装置E中收集到水240mL,测得1mol x气体的体积是24000 mL,则x的摩尔质量为________;x的化学式是________;(气体体积均换算成相同状况下的体积);
(2)B中发生化学反应的方程式是________(假设x在该条件下不分解)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中![]() 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、![]() 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为![]() 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,![]() 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,![]() 与I-反应的离子方程式___________________________________。
与I-反应的离子方程式___________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中![]() 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将![]() 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2012届江西省南昌外国语学校高三上学期期中考试化学(理)试卷 题型:填空题
(8分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑ +2H2O
+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI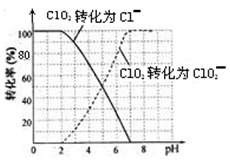
①请写出pH≤2 .0时ClO2--与I-反应的离子方程式 。
②请完成相应的实验 步骤:
步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为  mol·L-1(用含字母的代数式表示)。
mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省宁德市高三5月质检理综化学试卷(解析版) 题型:实验题
实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2 2O3)。
2O3)。
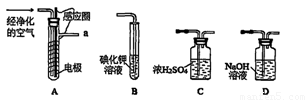
(1)空气通入A装置之前,应先后通过上述装置中的 、 (填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为 。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称 。
②若实验时通入空气1.12L(标准状况),O2的转化率为 。
③测定时需在A、B装置间连接装置D,原因是 。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是 (填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com