
铝是一种重要的金属。
(1)铝在元素周期表中的位置是__________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。
(3)铝与NaOH溶液反应的离子方程式为____________________________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中加入等质量的Al,产生气体的体积比为5∶6,则所加Al的质量为__________。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________________________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) ______________________。
解析:(3)2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,由上述两个方程式可以看出,当盐酸与NaOH的物质的量相同时,产生H2的体积比为1∶3,现为5∶6>1∶3,故加入的Al相对盐酸过量,对NaOH不足。0.2 mol的HCl需Al质量为![]() ×27 g/mol×0.2 mol=1.8 g,对应5份H2,当H2为6份时,铝的质量为
×27 g/mol×0.2 mol=1.8 g,对应5份H2,当H2为6份时,铝的质量为![]() ×1.8 g=2.16 g,即为所求。
×1.8 g=2.16 g,即为所求。
答案:(1)第3周期第ⅢA族
(2)2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
(3)2Al+2OH-+2H2O===2AlO![]() +3H2↑ 2.16 g
+3H2↑ 2.16 g
(4)加热浓缩、冷却结晶、过滤
Al3++3H2O![]() Al(OH)3+3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到 AlCl3。
Al(OH)3+3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到 AlCl3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
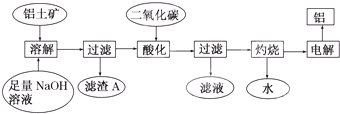
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式 ,滤渣A的主要成分为 。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为 _______ 。
(3)电解氧化铝,每生成1molAl时,生成 g氧气。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属。
(1)铝在元素周期表中的位置是________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。
(3)铝与NaOH溶液反应的离子方程式为:__________________________;
同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中各加入等质量的Al,产生气体的体积比为5:6,则所加Al的质量为________。
查看答案和解析>>
科目:高中化学 来源:2011—2012学年福州八中高一上学期期末考试化学试卷 题型:填空题
(12分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式 ,滤渣A的主要成分为 。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为 _______ 。
(3)电解氧化铝,每生成1molAl时,生成 g氧气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com