
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
【答案】D
【解析】
A. 硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,A项错误;
B. 由C(石墨)=C(金刚石);△H=+1.90kJ/mol可知金刚石的能量比石墨的能量高,所以石墨比金刚石稳定,B项错误;
C. 2gH2的物质的量为1mol,则燃烧2mol H2放出的热量为2![]() 285.8 kJ/mol=571.6 kJ/mol氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣571.6 kJ/mol,C项错误;
285.8 kJ/mol=571.6 kJ/mol氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣571.6 kJ/mol,C项错误;
D. 浓硫酸稀释会放出一部分热量,所以根据中和热的热化学方程式可知,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是
2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是

A. 2SO2(g) +O2(g) ![]() 2SO3(1) △H>-a kJ/mol
2SO3(1) △H>-a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 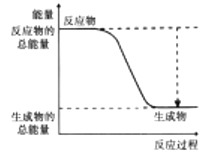 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)当反应进行到第_______min,该反应达到平衡。
(2)计算X的转化率______。
(3)计算反应从开始至2分钟末,Z物质的化学反应速率______。
(4)由图中所给数据进行分析,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.硫酸型酸雨的形成会涉及反应:![]()
B.用苛性钠溶液吸收过量SO2:![]()
C.足量氯水和碘化亚铁溶液的反应:![]()
D.工业上氯气和石灰乳反应制漂白粉:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用100mLNaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)原NaOH溶液的物质的量浓度为______;
(2)题中通入CO2后所得溶液中的溶质有______,溶液中溶质的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
图1
图2
图3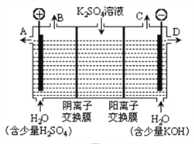
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为___________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.稀硫酸溶液中不存在H2SO4分子
B.凡是能电离的物质一定能达到电离平衡
C.氯化钠溶液在电流作用下电离成钠离子和氯离子
D.氨水中全部是NH4+、OH-,无分子存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com