
【题目】实验室用100mLNaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)原NaOH溶液的物质的量浓度为______;
(2)题中通入CO2后所得溶液中的溶质有______,溶液中溶质的物质的量之比为______。
【答案】1.5mol/L Na2CO3和NaHCO3 1:1
【解析】
(1)加入75mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×2mol/L=0.15mol,所以c(NaOH)=0.15mol/0.1L=1.5mol/L,故答案为:1.5mol/L;
(2)当向100mLNaOH溶液中通入一定量的CO2气体时,发生的反应有:2NaOH+CO2=Na2CO3+H2O,还可能有:NaOH+CO2=NaHCO3,根据图象可知,由于无气体产生阶段消耗的盐酸为25mL,而有气体生成的阶段消耗的盐酸为50mL,可知溶液的成分为Na2CO3和NaHCO3的混合物;当向溶液中加盐酸的体积25mL时,无气体出现,说明此段内发生了如下反应:HCl+Na2CO3=NaHCO3+NaCl,再加盐酸时产生气体,即25mL-75mL共消耗50mL的盐酸,发生NaHCO3+HCl=CO2↑+NaCl+H2O,所以Na2CO3和NaHCO3的物质的量之比为1:1,故答案为:Na2CO3和NaHCO3;1:1。


科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图银锌原电池中,以硫酸铜为电解质溶液。

(1)锌为______极,该电极上发生的是_____________反应(“氧化”或“还原”),电极反应式为__________________________________。
(2)银为____极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式是__________________,银片上观察到的现象是__________________________。
(3)该原电池的总反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
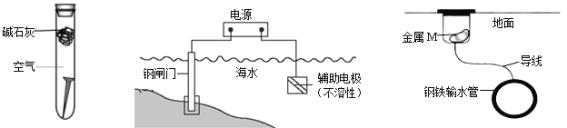
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学分别按图1所示装置进行实验,甲同学在虚线框内接一个电流计,乙同学在虚线框内没有做连接,请回答下列问题:
(1)以下叙述正确的是______
A.甲同学实验中,石墨棒上无气泡产生
B.甲、乙两同学实验中的铁片都是负极
C.甲同学实验中,电子在溶液中没有迁移
D.甲、乙同学在实验中都发现有气泡生成,产生气泡的速率甲比乙慢
(2)甲同学观察到电流计指针发生偏转,根据实验中的发现,绘制了图2,X轴表示实验时流入正极的电子的物质的量,则Y轴可能表示______
A.石墨棒的质量B.铁棒的质量C.c(H+)D.c(SO42-)E.c(Fe2+)
(3)采用甲同学装置,实验时把稀硫酸换成硫酸铜溶液,请写出铁电极电极反应式:______,石墨电极观察到的现象______,发生了______反应(填“氧化”、“还原”或“非氧化还原”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
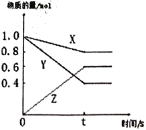
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
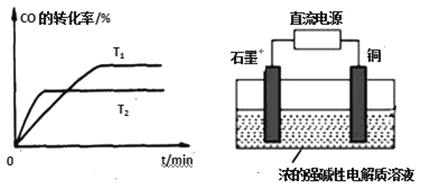
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com