
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
分析 A.碳原子的核电荷数为6,原子符号的左下角表示的为质子数,应该为6;
B.乙醇为饱和一元醇,分子中含有2个碳原子;
C.乙烯分子中含有碳碳双键,结构简式中没有标出官能团结构;
D. 为甲烷的比例模型,不是球棍模型.
为甲烷的比例模型,不是球棍模型.
解答 解:A.碳原子的质子数为6,原子核内有8个中子的碳原子表示为:146C,故A错误;
B.乙醇为含有2个碳原子的不会一元醇,乙醇的结构简式为:C2H5OH,故B正确;
C.乙烯为烯烃,分子中含有官能团碳碳双键,其正确的结构简式为:CH2=CH2,故C错误;
D.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: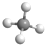 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型与球棍模型、结构简式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 200 mL 2 mol/L MgCl2溶液 | B. | 400 mL 2.5 mol/L NaCl溶液 | ||
| C. | 250 mL 1 mol/L AlCl3溶液 | D. | 300 mL 5 mol/L KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
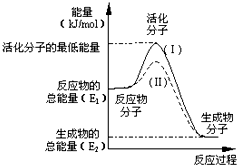 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
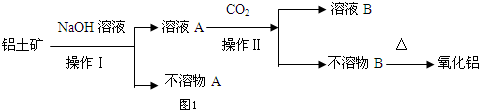
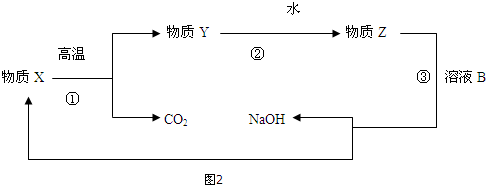
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 | |
| D. | 某基态原子核外电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
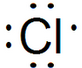 .
.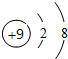 .
.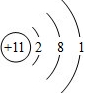 D2-的电子式为
D2-的电子式为 .
. ;Z元素原子的电子式为
;Z元素原子的电子式为 .
.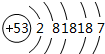 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com