
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 | |
| D. | 某基态原子核外电子排布图为: |
分析 A.铁原子序数为26;
B.35Br的电子排布式为1s22s22p63s23p63d104s24p5;
C.NH4Cl的电子式中氯离子没有标出最外层电子;
D.简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子.
解答 解:A.铁原子序数为26,价层电子排布式为3d64s2,故A正确;
B.35Br的电子排布式为1s22s22p63s23p63d104s24p5,则35Br的电子排布式可简写为[Ar]3d104s24p5,故B错误;
C.NH4Cl为离子化合物,阴阳离子需要标出所带电荷,铵根离子和氯离子还应该标出最外层电子,氯化铵正确的电子式为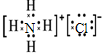 ,故C错误;
,故C错误;
D.某一基态2p能级上仅有4个电子,这4个电子分别占据不同的轨道,且自旋方向相同,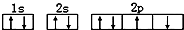 该排布图违背了洪特规则,故D错误.
该排布图违背了洪特规则,故D错误.
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、电子排布式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
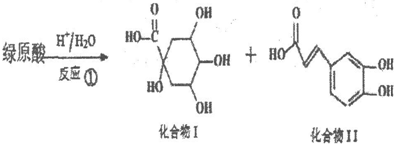
 .
.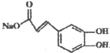 ),则试剂X是NaHCO3溶液.
),则试剂X是NaHCO3溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:3:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| B. | 1mol金刚石中含有的共价键数目为4NA | |
| C. | 1molNa2O2与足量的水反应,转移的电子数为2NA | |
| D. | 分子数为NA的CO、N2的混合气体在标准状况时体积约为22.4L,质量为28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com