
科目:高中化学 来源: 题型:

| n(NH3) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源:高考总复习全解 化学 一轮复习·必修课程 (人教实验版) 人教实验版 题型:013
|
当空气中混有5%~15%的甲烷时,点燃会发生爆炸,当爆炸最强烈时,甲烷的含量为 | |
| [ ] | |
A. |
9.1% |
B. |
10.5% |
C. |
10% |
D. |
5% |
查看答案和解析>>
科目:高中化学 来源:广东省珠海二中2008-2009学年高二下学期6月月考化学试题 题型:058
环己酮(微溶于水,易溶于醇和醚,沸点155.7℃)是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):

实验步骤如下:
①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.控制瓶内温度在55℃~60℃之间,充分反应0.5 h.
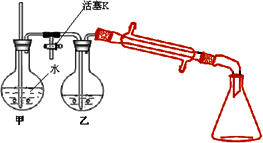
③向②反应后的圆底烧瓶内加入少量水,并接入右图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体分液,水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层.再向有机层中加入无水硫酸钠静置后转入干燥的圆底烧瓶中,进行蒸馏,除去乙醚后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是________.
(2)步骤③利用图示装置进行实验的目的是________,实验过程中要经常检查甲中玻璃管内的水位.若玻璃管内的水位升高过多,其可能原因是________,此时应立即采取的措施是________.
(3)步骤④中加入无水硫酸钠的作用是________,蒸馏除乙醚的过程中采用的加热方式为________.
(4)写出该实验中可能发生的一个副反应的化学方程式________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八市高三三月联考理综化学试卷(解析版) 题型:填空题
氮元素及其化合物在国防科学技术生产中有重要应用。
(1)写出实验室制NH3的化学反应方程式 ???????????
(2)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 ?? 。
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ???????????????????????????? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ???????????????????????????? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
(4)在容积为2L容器中发生反应CO(g)+H2O(g) CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(CO)与反应时间t变化曲线Ⅱ

(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素时,当氨碳比 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”)
②NH3的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)测定有机物中碳和氢的质量分数,常用燃烧分析法,用氧化铜为催化剂,在750℃左右使有机物在氧气流中全部氧化成CO2和H2O;分别用装有固体NaOH和Mg(ClO4)2的吸收管吸收CO2和H2O。某课外活动小组,设计利用下图所示装置制取纯净干燥的乙烯,并测定乙烯分子中碳、氢原子的个数比;甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯被氧化成CO2和H2O。请回答下列问题:
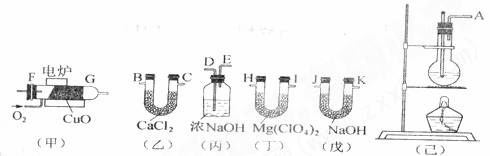
(1)整套装置的连接顺序(按气流方向从左到右填写仪器的接口字母):
(不考虑吸收空气的CO2或H2O)
A接▲ , _▲_接___▲___,_▲____接 ▲ , ▲ 接▲ , ▲ 接J…
(2)烧瓶中的试剂是浓硫酸和酒精,浓硫酸的作用是: ▲ ;
(3)实验时应使烧瓶中溶液的温度迅速升至170℃,原因是 ▲ ;
(4)乙装置的作用是 ▲ ,丙装置的作用是 ▲ ;
(5)若实验前后,丁增重ag、戊增重bg,则测得乙烯分子中C、H原子的个数比为
▲ ;
(6)若测得的比值偏高,导致这种误差的可能的原因是 ▲ ;
A.乙烯中混有少量的CO B.乙烯进入燃烧管时,含有少量的水蒸气
C.乙烯中混有少量的乙醚(C2H5OC2H5) D.乙烯进入燃烧管时,含有少量的CO2
(7)若仍用此装置测定某烃A的化学式。经测定:丁增重4.5g、戊增重8.8g,
则A的分子式为 ▲ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com